题目内容
14.夏季,香甜可口、营养丰富的西瓜是人们喜爱的水果之一,下表列出的是每100g某品种西瓜可食用部分的主要营养成分数据.| 营养成分 | 水分 | 蛋白质 | 脂肪 | 糖类 | X | 钙、磷、铁、锌 |
| 质量 | 92.5g | 0.7g | 0.2g | 6.1g | 6.8mg | 17.1mg |
(2)小周上网查阅了有关西瓜中营养成分的信息(如表),其中钙元素是人体必需的常量(填“常量”或“微量”)元素.
(3)西瓜种植过程中可以施用下列化肥,其中属于复合肥的是C(填字母).
A.NH4HCO3 B.KCl C.NH4H2PO4.
分析 (1)西瓜属于水果,其中含有丰富的维生素;
(2)根据微量元素和常量元素的区别和种类回答;
(3)含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥,同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥.
解答 解:(1)西瓜属于水果,其中含有丰富的维生素,所以X是维生素.
(2)人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒;则钙元素属于人体必需的常量元素.
(3)A.NH4HCO3含有氮元素,属于氮肥; B.KCl含有钾元素,属于钾肥; C.NH4H2PO4.含有氮元素和磷元素,属于复合肥.
故答案为:(1)维生素;(2)常量;(3)C.
点评 “民以食为天”,在生活水平不断提高的今天,人们把对健康饮食的追求提上了生活的日程,所以对六大营养素的考查也成了热点之一,特别是六大营养素包括的种类、生理功能、食物来源、缺乏症,摄入时的注意事项等内容.

练习册系列答案
相关题目
4.1985年发现一种新分子,化学式为C60,下列说法不正确的是( )
| A. | 它是一种单质 | B. | 在O2中燃烧的产物是CO2 | ||
| C. | 一个分子中含有60个碳原子 | D. | 它是一种新型的化合物 |
2.同一个化学反应在不同条件下反应的快慢(即反应速率)是不同的.下列三组实验是探究不同条件对金属锌与盐酸反应速率的影响
(1)将表中的空格填写完整①锌粉 ②浓度 ③5g锌粒
(2)请写出锌与稀盐酸反应的化学方程式Zn+2HCl=ZnCl2+H2↑
(3)为了提高铁与盐酸反应的反应速率,请提出一种实验方案使用铁粉(或增大盐酸浓度;或加热等合理答案皆可)
(4)综合其它实验结果,相同质量的铁、锌、铜与足量的稀盐酸反应产生氢气的质量关系如图,其中正确的是D(填选项)
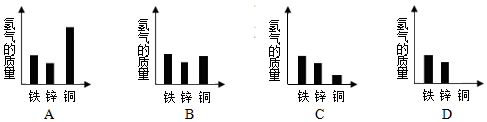
| 实验操作 | 现象 | 结论 | |
| 第1组 | 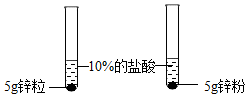 | ①锌粉(选填“锌粒”或“锌粉”)反应更加剧烈. | 反应物表面积越大,反应速率越大. |
| 第2组 | 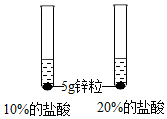 | 锌粒与20%的盐酸反应更加剧烈. | 反应物②浓度越大,反应速率越大. |
| 第3组 | 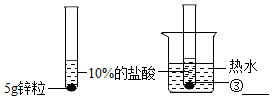 | 置于热水的试管反应更加剧烈. | 温度越高,反应的速率越大. |
(2)请写出锌与稀盐酸反应的化学方程式Zn+2HCl=ZnCl2+H2↑
(3)为了提高铁与盐酸反应的反应速率,请提出一种实验方案使用铁粉(或增大盐酸浓度;或加热等合理答案皆可)
(4)综合其它实验结果,相同质量的铁、锌、铜与足量的稀盐酸反应产生氢气的质量关系如图,其中正确的是D(填选项)

9.碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业.有一种碳酸盐矿石其主要成分为碳酸钡和碳酸钙,以此矿石为原料生产碳酸钡的流程如图所示:

【查阅资料】①碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的氢氧化物,这两种氢氧化物均可以和二氧化碳反应.但氢氧化物溶解度有一定的差异,下表所示的是两种氢氧化物在不同温度下的溶解度.
②碳酸钡也能与稀盐酸反应,化学方程式:BaCO3+2HCl=BaCl2+H2O+CO2↑
(1)矿石研磨成粉末的目的增大接触面积,充分反应;
(2)以下相关说法正确的是AC;
A.焙烧炉中添加焦炭粉和热空气是为了维持炉内的高温状态
B.焙烧炉内只涉及分解反应
C.废渣需要经过洗涤才能弃渣,是为了保护环境,同时充分利用原料
(3)写出焙烧炉中碳酸钙发生分解反应的化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(4)除了水之外,进入分离池中的物质是Ba(OH)2和Ca(OH)2,请你推测分离池中操作②的方法是B(选填“A”或“B”) A.降温,过滤; B.加热,过滤
(5)写出由溶液B制取产品的化学方程式:Ba(OH)2+CO2=BaCO3↓+H2O;
(6)为测定此矿石中碳酸钡的质量分数,选矿石原料200g,制取纯净的碳酸钡,再往其中加入200g溶质质量分数为 7.3%稀盐酸恰好完全反应,则该矿石原料中碳酸钡的纯度为多少?

【查阅资料】①碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的氢氧化物,这两种氢氧化物均可以和二氧化碳反应.但氢氧化物溶解度有一定的差异,下表所示的是两种氢氧化物在不同温度下的溶解度.
| 温度/℃ | 0 | 40 | 80 |
| Ca(OH)2溶解度/g | 0.187 | 0.141 | 0.094 |
| Ba(OH)2溶解度/g | 1.67 | 8.22 | 101.4 |
(1)矿石研磨成粉末的目的增大接触面积,充分反应;
(2)以下相关说法正确的是AC;
A.焙烧炉中添加焦炭粉和热空气是为了维持炉内的高温状态
B.焙烧炉内只涉及分解反应
C.废渣需要经过洗涤才能弃渣,是为了保护环境,同时充分利用原料
(3)写出焙烧炉中碳酸钙发生分解反应的化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(4)除了水之外,进入分离池中的物质是Ba(OH)2和Ca(OH)2,请你推测分离池中操作②的方法是B(选填“A”或“B”) A.降温,过滤; B.加热,过滤
(5)写出由溶液B制取产品的化学方程式:Ba(OH)2+CO2=BaCO3↓+H2O;
(6)为测定此矿石中碳酸钡的质量分数,选矿石原料200g,制取纯净的碳酸钡,再往其中加入200g溶质质量分数为 7.3%稀盐酸恰好完全反应,则该矿石原料中碳酸钡的纯度为多少?
6.下列四个图象分别对应四种操作(或治疗)过程,其中正确的是( )
| A. |  用胃舒平[主要成分Al(OH)3]治疗胃酸过多时pH情况 | |
| B. |  分别向稀盐酸中加入等质量的Fe和Mg | |
| C. |  将质量相等的两份药品a和b分别加热,a是混有少量二氧化锰的氯酸钾,b是纯净的氯酸钾 | |
| D. |  在饱和的KNO3溶液中加入KNO3晶体 |
3.根据如图的信息判断,下列说法错误的是( )


| A. | 硫原子的相对原子质量为32.07 g | B. | 硫原子的核电荷数为16 | ||
| C. | 硫元素属于非金属元素 | D. | 硫元素符号是大写的英文字母:S |
4.通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某工厂设计了如下流程
将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体.
[资料准备]
(1)步骤①和②的目的是除去粗盐中的难溶性杂质.
(2)操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
(3)步骤③的主要目的是MgCl2+2NaOH═Mg(OH)2↓+2NaCl (用化学方程式回答);判断氢氧化钠溶液已过量的方法是取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
(4)步骤⑤中加稀盐酸的目的是除去溶液中过量的氢氧化钠和碳酸钠.用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小.
(5)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法不可行(选填“可行”或“不可行”),理由是MgCO3,Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.

将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体.
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| OH- | CO32- | |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
(2)操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
(3)步骤③的主要目的是MgCl2+2NaOH═Mg(OH)2↓+2NaCl (用化学方程式回答);判断氢氧化钠溶液已过量的方法是取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
(4)步骤⑤中加稀盐酸的目的是除去溶液中过量的氢氧化钠和碳酸钠.用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小.
(5)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法不可行(选填“可行”或“不可行”),理由是MgCO3,Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
 为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如图所示的实验(假设该样品中只含有氯化钠一种杂质),注:实验过程中发生反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑.
为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如图所示的实验(假设该样品中只含有氯化钠一种杂质),注:实验过程中发生反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑.