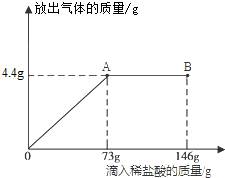
题目内容
某学校课外活动小组为了测定某石灰石样品中碳酸钙的质量分数,在实验室中称取样品12g放入烧杯中(烧杯的质量为30g),然后再加入100g稀盐酸,两者恰好完全反应,称量,烧杯及烧杯中物质的总质量为137.6g(已知杂质不参与反应).请计算:
(1)石灰石样品中碳酸钙的质量分数?
(2)该稀盐酸的溶质质量分数是多少?
(1)石灰石样品中碳酸钙的质量分数?
(2)该稀盐酸的溶质质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)样品质量和稀盐酸质量之和与剩余物质的质量之差即为生成二氧化碳的质量;根据化学方程式可以求出碳酸钙的质量,进一步可以计算石灰石样品中碳酸钙的质量分数;
(2)由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出稀盐酸中溶质的质量,进一步可以计算稀盐酸的溶质质量分数.
(2)由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出稀盐酸中溶质的质量,进一步可以计算稀盐酸的溶质质量分数.
解答:解:生成二氧化碳的质量为:12g+30g+100g-137.6g=4.4g.
故填:8.8g.
(2)解:设碳酸钙的质量为x,稀盐酸中溶质的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
=
=
x=10g y=7.3g
(1)石灰石样品中碳酸钙的质量分数
×100%≈83.3%
(2)稀盐酸的溶质质量分数是
×100%=7.3%
答案:
(1)石灰石样品中碳酸钙的质量分数83.3%
(2)稀盐酸的溶质质量分数是7.3%
故填:8.8g.
(2)解:设碳酸钙的质量为x,稀盐酸中溶质的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
| 100 |
| x |
| 73 |
| y |
| 44 |
| 4.4g |
x=10g y=7.3g
(1)石灰石样品中碳酸钙的质量分数
| 10g |
| 12g |
(2)稀盐酸的溶质质量分数是
| 7.3g |
| 100g |
答案:
(1)石灰石样品中碳酸钙的质量分数83.3%
(2)稀盐酸的溶质质量分数是7.3%
点评:解题的关键是生成的二氧化碳的质量,样品和稀盐酸相互作用后,只有二氧化碳逸出,所以反应前后烧杯中物质的质量之差即为生成二氧化碳的质量.

练习册系列答案
相关题目
稀硫酸、氢氧化钠溶液和澄清石灰水都是无色透明的溶液.下列能将它们鉴别开的物质是( )
| A、氯化钠溶液 | B、稀盐酸 |
| C、二氧化碳 | D、碳酸钠溶液 |
 见图,如果U型管右升左降,则加入左边试管的物质可能是
见图,如果U型管右升左降,则加入左边试管的物质可能是