题目内容
10.甲、乙、丙是三个实验的示意图,根据下图中所发生的化学反应,进行总结归纳并回答下列问题: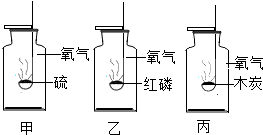
(1)所发生的三个反应有多个共同的特点,分别是:
①反应物都有氧气;②反应条件为点燃.
(2)请再写出一个符合该特点的反应符号表达式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
分析 (1)硫、磷、木炭与氧气反应分别生成二氧化硫、五氧化二磷和二氧化碳,都属于化合反应,也属于氧化反应,并且都是在点燃的条件下才能燃烧,反应都放出热量等;而不同之处主要在于它们的生成物的状态,产生的火焰等方面;
(2)根据铁和氧气在点燃的条件下生成丝氧化三磷,写出反应的符号表达式.
解答 解:(1)根据图中所发生的化学反应,进行总结归纳,它们的共同点为:①反应物都有氧气;②反应条件为点燃;③都为化合反应;④都是氧化反应等;
(2)铁在氧气中燃烧生成了四氧化三铁,符合上述特点,反应的化学方程式是:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
故答案为:
(1)反应物都有氧气;反应条件为点燃等;(2)3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
点评 熟练掌握氧气的化学性质,并熟记常见物质在氧气中燃烧的现象和产物,才能顺利解答.

练习册系列答案
相关题目
20. 如图是水分子分解示意图.图中的大球表示氧原子,小球表示氢原子,球与球相连接的图形分别表示水分子、氧分子和氢分子.从水分子分解示意图获得的信息中错误的是( )
如图是水分子分解示意图.图中的大球表示氧原子,小球表示氢原子,球与球相连接的图形分别表示水分子、氧分子和氢分子.从水分子分解示意图获得的信息中错误的是( )
 如图是水分子分解示意图.图中的大球表示氧原子,小球表示氢原子,球与球相连接的图形分别表示水分子、氧分子和氢分子.从水分子分解示意图获得的信息中错误的是( )
如图是水分子分解示意图.图中的大球表示氧原子,小球表示氢原子,球与球相连接的图形分别表示水分子、氧分子和氢分子.从水分子分解示意图获得的信息中错误的是( )| A. | 分子由原子构成 | |
| B. | 原子是化学变化中的最小粒子 | |
| C. | 参加反应的各物质在反应前后元素的种类和原子的个数都不会发生改变 | |
| D. | 水是由一个氧分子和2个氢分子构成 |
15.利用铝合金代替铝制钥匙,主要利用铝合金的( )
| A. | 密度小 | B. | 熔点低 | C. | 耐腐蚀 | D. | 硬度大 |
7.为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,同学们通过测定了反应后溶液的pH,得到了如图1所示的pH曲线,请回答:
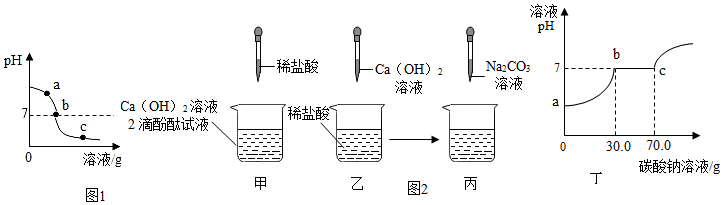
(1)由图可知该实验操作是将稀盐酸 滴加到另一种溶液中
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色
的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
(4)同学们做甲、乙两个中和反应实验的探究(如图2).
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图丁所示.请计算该溶液中CaCl2的溶质质量分数.(写出计算过程,精确到0.1%)

(1)由图可知该实验操作是将稀盐酸 滴加到另一种溶液中
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色
的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 另取少量余下样品于两支试管中,分别滴加足量的Na CO,溶液 | 只产生白色沉淀 | 该样品为b处溶液 |
| 先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知液中的阳离子有Ca2+、H+ |
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图丁所示.请计算该溶液中CaCl2的溶质质量分数.(写出计算过程,精确到0.1%)
 如图所示,A、B、C、D、E、F均是初中化学常见物质.A与B发生的是复分解反应,B与C发生的是中和反应,F是人体正常生理活动必不可少的一种盐.
如图所示,A、B、C、D、E、F均是初中化学常见物质.A与B发生的是复分解反应,B与C发生的是中和反应,F是人体正常生理活动必不可少的一种盐.