题目内容
9. 化学与生活密切相关.
化学与生活密切相关.(1)如图是某校食堂的食谱,从所含营养素分析,除水和无机盐外,主食中主要含有营养素是糖类,食谱中缺少的营养素是维生素.
(2)小强去医院体检,医生说他有点贫血,你认为他应该适当补充铁元素.
(3)炒菜时油锅着火,可用锅盖盖灭.其灭火原理是隔绝空气(或氧气).
(4)生活中常用煮沸的方法降低水的硬度,同时又可以杀菌消毒.
分析 (1)根据食谱中的食物中所含营养素的种类、人体内六大营养素的种类及食物来源回答;根据食谱中还缺乏的一种营养素是维生素进行解答;
(2)根据铁的生理功能判断;
(3)炒菜时油锅着火可用锅盖盖灭,其灭火原理是隔绝空气(或氧气),使火焰熄灭;
(4)根据降低水的硬度的方法进行分析解答.
解答 解:(1)在食谱中所列的食物中,主食米饭、馒头中主要含糖类,烧鱼类中富含蛋白质和油脂,鸡蛋中主要含蛋白质和少量无机盐,牛奶中主要含蛋白质;该食谱中还缺乏的一种营养素是维生素,维生素主要存在于蔬菜和水果中,如青菜、苹果等;
(2)铁是合成血红蛋白的主要元素,缺乏会患贫血,医生诊断说是贫血,所以他需要补充的元素铁元素;
(3)炒菜时油锅着火可用锅盖盖灭,其灭火原理是隔绝空气(或氧气),使火焰熄灭;
(4)对水加热煮沸时,可使水中钙、镁离子形成沉淀,同时能杀死病菌达到杀菌消毒的目的,因此生活中既能降低水的硬度,又能杀菌消毒的方法是煮沸.
故答案为:(1)糖类;维生素;(2)铁;(3)隔绝空气(或氧气);(4)煮沸.
点评 “吃得营养,吃出健康”是人类普遍的饮食追求,人们把对健康饮食的追求提上了生活的日程,所以对六大营养素的考查也成了热点之一,特别是六大营养素包括的种类、生理功能、食物来源、缺乏症,摄入时的注意事项等内容.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
19.下面是对四个实验绘制的图形,其中实验结果与图形对应准确的是( )


| A. | 图①为向pH=0的盐酸中加入水 | |
| B. | 图②为向稀盐酸中加入适量NaOH溶液 | |
| C. | 图③为25℃下,在一定量水中加入氯化钠固体 | |
| D. | 图④为过量的镁粉、过量的铝粉分别与等量的盐酸反应 |
17.以下实验现象描述不正确的是( )
| A. | 铁丝在氧气中燃烧,火星四射 | B. | 红磷在空气中燃烧产生大量白烟 | ||
| C. | 镁条在空气中燃烧发出耀眼的白光 | D. | 硫粉在氧气中燃烧产生淡蓝色火焰 |
4.下列选项中,除杂试剂或方法不正确的是( )
| 选项 | 物质 | 杂质 | 除杂试剂或方法 |
| A | KCl | MnO2 | 溶解、过滤、蒸发 |
| B | NaCl | Na2CO3 | 加入适量稀硫酸、蒸发 |
| C | Cu | CuO | 加入足量稀盐酸、过滤 |
| D | CaO | CaCO3 | 高温煅烧 |
| A. | A | B. | B | C. | C | D. | D |
1. 如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
 如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )| A. | 该实验是将稀硫酸滴入氢氧化钠溶液中 | |
| B. | 曲线上A点的溶液里溶质有H2SO4、Na2SO4和NaOH | |
| C. | 取曲线上M点的溶液,向其中滴入无色酚酞试液,溶液变红色 | |
| D. | 曲线上B点的溶液里溶质有两种 |
18.碳酸钠和碳酸氢钠是生活中常见的盐.通过实验验证、探究它们的化学性质.
【查阅资料】
①Na2CO3+CaCl2=CaCO3↓+2NaCl
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
③Ca(HCO3)2易溶于水.
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合的现象(表中的百分数为溶液中溶质的质量分数):
【进行实验】
【解释与结论】
(1)实验1中,NaHCO3与盐酸反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.
(2)实验2中,试剂a为澄清的石灰水.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:2NaHCO3+CaCl2=CaCO3↓+2NaCl+CO2↑+H2O.
【反思与评价】
(1)实验2中,加热NaHCO3后,试管I中残留固体成分可能为Na2CO3;Na2CO3,NaHCO3(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊,未观察到气泡,原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡.
(3)用2中不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:①各取少量0.1%的NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3.②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
【查阅资料】
①Na2CO3+CaCl2=CaCO3↓+2NaCl
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
③Ca(HCO3)2易溶于水.
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合的现象(表中的百分数为溶液中溶质的质量分数):
| NaHCO3 | Na2CO3 | ||||
| 0.1% | 1% | 5% | 0.1% | ||
| CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
| 1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
| 5% | 无明显现象 | 有浑浊 | 有沉淀,有大量气泡 | 有沉淀 | |
| 序号 | 实验装置 | 主要实验步骤 | 实验现象 |
| 实验1 |  | 向2支试管中分别加入少量Na2CO3和NaHCO3溶液,再分别滴加盐酸 | 2支试管中均有气泡产生 |
| 实验2 | 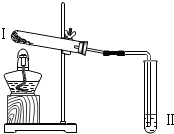 | 向II中加入试剂a,向I中加入少量Na2CO3或NaHCO3固体,分别加热一段时间 | Na2CO3受热时II中无明显现象 NaHCO3受热时II中出现浑浊 |
| 实验3 | 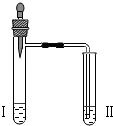 | 向II中加入试剂a,向I中加入少量5%的NaHCO3溶液,再滴加5%的CaCl2溶液 | I中出现浑浊,有气泡产生 II中出现浑浊 |
(1)实验1中,NaHCO3与盐酸反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.
(2)实验2中,试剂a为澄清的石灰水.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:2NaHCO3+CaCl2=CaCO3↓+2NaCl+CO2↑+H2O.
【反思与评价】
(1)实验2中,加热NaHCO3后,试管I中残留固体成分可能为Na2CO3;Na2CO3,NaHCO3(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊,未观察到气泡,原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡.
(3)用2中不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:①各取少量0.1%的NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3.②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
1.下列关于分子、原子的说法,正确的是( )
| A. | 原子是最小的微粒,不能再分 | |
| B. | 一个H2O分子中含有一个H2分子 | |
| C. | 当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔 | |
| D. | 分子、原子都可以直接构成物质 |
 如图一是元素周期表中铁元素的相关信息,图二为某粒子结构示意图.试完成下列问题:
如图一是元素周期表中铁元素的相关信息,图二为某粒子结构示意图.试完成下列问题: