题目内容
将一定质量的甲烷和一氧化碳的混合气体在足量的氧气中充分燃烧,将生成物依次通入盛有足量浓硫酸和氢氧化钠溶液的洗气瓶,实验测得装有浓硫酸的洗气瓶增重5.4克,装有氢氧化钠溶液的洗气瓶增重8.8克.试计算:
(1)混合气体中甲烷的质量(写出完整的计算过程)
(2)混合气体中甲烷和一氧化碳的质量之比为 ,混合气体中碳、氢、氧三种元素的质量之比为 .
(1)混合气体中甲烷的质量(写出完整的计算过程)
(2)混合气体中甲烷和一氧化碳的质量之比为
考点:根据化学反应方程式的计算,化合物中某元素的质量计算,质量守恒定律及其应用
专题:有关化学方程式的计算
分析:CO和CH4组成的混合气体在O2中充分燃烧生成二氧化碳与水,浓硫酸吸水,故浓H2SO4增重5.4克为生成的水的质量,NaOH溶液吸收二氧化碳,所以NaOH溶液增重8.8克为二氧化碳质量,结合水的质量根据氢原子守恒计算甲烷的质量,结合二氧化碳的质量根据碳原子守恒计算一氧化碳的质量,据此进行判断.
解答:解:CO和CH4组成的混合气体在O2中充分燃烧生成二氧化碳与水,
NaOH溶液吸收二氧化碳,故NaOH溶液增重8.8克为二氧化碳质量,所以生成二氧化碳中碳元素的质量:8.8g×
×100%=2.4g,
浓硫酸吸水,故浓H2SO4增重5.4克为生成的水的质量,所以生成的水中氢元素的质量为:5.4g×
×100%=0.6g
根据氢原子守恒,所以甲烷的质量:0.6g÷
×100%=2.4g
根据碳原子守恒,一氧化碳中碳元素的质量=二氧化碳中碳元素的质量-甲烷中碳元素的质量=2.4g-(2.4g-0.6g)=0.6g,
所以一氧化碳的质量=
×100%=0.6g÷
×100%=1.4g.
所以原混合物中CH4与CO的质量之比为2.4g:1.4g=12:7.
混合气体中碳、氢、氧三种元素的质量之比为:2.4g:0.6g:(2.4g+1.4g-2.4g-0.6g)=12:3:4
故答案为:(1)2.4g;(2)12:7; 12:3:4.
NaOH溶液吸收二氧化碳,故NaOH溶液增重8.8克为二氧化碳质量,所以生成二氧化碳中碳元素的质量:8.8g×
| 12 |
| 44 |
浓硫酸吸水,故浓H2SO4增重5.4克为生成的水的质量,所以生成的水中氢元素的质量为:5.4g×
| 2 |
| 18 |
根据氢原子守恒,所以甲烷的质量:0.6g÷
| 4 |
| 16 |
根据碳原子守恒,一氧化碳中碳元素的质量=二氧化碳中碳元素的质量-甲烷中碳元素的质量=2.4g-(2.4g-0.6g)=0.6g,
所以一氧化碳的质量=
| 一氧化碳中碳元素的质量 |
| 一氧化碳中碳元素的百分含量 |
| 12 |
| 28 |
所以原混合物中CH4与CO的质量之比为2.4g:1.4g=12:7.
混合气体中碳、氢、氧三种元素的质量之比为:2.4g:0.6g:(2.4g+1.4g-2.4g-0.6g)=12:3:4
故答案为:(1)2.4g;(2)12:7; 12:3:4.
点评:考查混合物的计算,难度中等,关键利用原子守恒计算混合物中甲烷与一氧化碳的质量.

练习册系列答案
相关题目
下列归纳和推理,你认为不合理的是( )
| A、冰和干冰,组成元素不同-物质分类相同 |
| B、纯碱和烧碱,组成元素不同-物质分类相同 |
| C、金刚石和石墨,组成元素相同,原子排列不同-物理性质不同 |
| D、一氧化碳和二氧化碳,组成元素相同,分子结构不同-化学性质不同 |

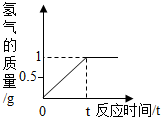 黄铜主要是由铜和锌组成的铜锌合金,它强度高,可塑性好,易加工,耐腐蚀.使用范围广.化学实验小组的同学想知道某种黄铜中铜和锌的含量,他们将100g黄铜磨成粉沫,然后放入盛有足量稀盐酸的烧杯中,反应生成氢气的量与时间的关系如图.试回答:
黄铜主要是由铜和锌组成的铜锌合金,它强度高,可塑性好,易加工,耐腐蚀.使用范围广.化学实验小组的同学想知道某种黄铜中铜和锌的含量,他们将100g黄铜磨成粉沫,然后放入盛有足量稀盐酸的烧杯中,反应生成氢气的量与时间的关系如图.试回答:
 某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定. 已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物;D、E、F三种物质含有同种非金属元素,其中F是单质,E是易与血液中血红蛋白结合的有毒气体.它们之间的转化关系如图所示(有些转换关系,反应条件等略去),试回答:
已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物;D、E、F三种物质含有同种非金属元素,其中F是单质,E是易与血液中血红蛋白结合的有毒气体.它们之间的转化关系如图所示(有些转换关系,反应条件等略去),试回答: