题目内容
6.下列过程主要发生化学变化的是( )| A. | 酒精、醋酸、汽油等物质挥发 | B. | 蜡烛变形 | ||
| C. | 工业上由液态空气制得氧气 | D. | 绿色植物的光合作用 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成.
解答 解:A、酒精、醋酸、汽油等物质挥发出气体分子的过程中只是物质的状态发生了改变,没有新物质生成,属于物理变化,故A错误;
B、蜡烛变形过程中只是形状发生变化,没有新物质生成,属于物理变化,故B错误;
C、工业上由液态空气制得氧气的过程中没有新物质生成,属于物理变化,故C错误;
D、绿色植物的光合作用的过程中有新物质氧气等生成,属于化学变化,故D正确.
故选D.
点评 解答本题要分析变化过程中是否有新物质生成,如果有新物质生成就属于化学变化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰.该小组同学进行了如下探究.
(1)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生.
由此可知:蜡烛燃烧产生的火焰是由气态(填“固态”或“气态”)物质燃烧形成的.
(2)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
由如表可知:物质燃烧能否产生火焰与其沸点(填“熔点”或“沸点”)和燃烧时温度有关.由此推测:钠在燃烧时,有(填“有”或“没有”)火焰产生.
(3)根据硫在空气或氧气中燃烧的实验事实,请你推测:硫的沸点< 硫燃烧时的温度.(填“>”或“<”或“=”)
(1)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生.
由此可知:蜡烛燃烧产生的火焰是由气态(填“固态”或“气态”)物质燃烧形成的.
(2)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
| 石蜡 | 50∽70 | 300∽550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
(3)根据硫在空气或氧气中燃烧的实验事实,请你推测:硫的沸点< 硫燃烧时的温度.(填“>”或“<”或“=”)
1.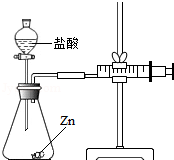 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响温度(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐溶液反应,现将ag铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为bg,则生成铜的质量为8(b-a)g.
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响温度(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐溶液反应,现将ag铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为bg,则生成铜的质量为8(b-a)g.
18.下列各组物质中,属于单质、化合物、混合物的是( )
| A. | 氧气 氧化镁 蒸馏水 | B. | 空气 氢氧化钠 稀盐酸 | ||
| C. | 氮气 氯化钠 大理石 | D. | 二氧化碳 氧化铜 空气 |
16.如表实验操作、现象与结论均正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 用拇指堵住收集了甲烷的试管口,靠近火焰,移开拇指点火 | 发出轻微爆鸣声 | 试管中气体为纯净物 |
| B | 往装有某溶液的试管中滴加稀硫酸 | 产生白色沉淀 | 一定含有Ba2+ |
| C | 把燃着的木条插入某瓶无色气体中 | 木条熄灭 | 该瓶中气体不一定是二氧化碳 |
| D | 在燃烧匙里放少量硫,加热,直到发生燃烧,然后把它伸进充满氧气的集气瓶中 | 硫在空气中燃烧发出淡蓝色火焰,而在氧气中燃烧更旺,发出蓝紫色火焰 | 氧气的浓度越小,燃烧越 |
| A. | A | B. | B | C. | C | D. | D |

