题目内容
11.下列物质:①含CaO99%的生石灰 ②CaO刚好与水反应的生成物 ③水银 ④浓盐酸 ⑤含铁70%的三氧化二铁,用编号填入下列空格:属混合物的是①④,属单质的是③,属化合物的是②⑤.分析 由两种或两种以上的物质混合而成的物质是混合物;由一种物质的组成的是纯净物;由同种元素组成的纯净物是单质;由不同种元素组成的纯净物是化合物;
解答 解:①含CaO99%的生石灰含有1%的杂质,属于混合物;②CaO刚好与水反应的生成物是氢氧化钙,属于化合物; ③水银是由汞一种元素组成,属于单质;④浓盐酸中含有氯化氢和水,属于混合物;⑤氧化铁中铁元素质量分数是70%,所以含铁70%的三氧化二铁属于纯净物,属于化合物.
故答案为:①④;③;②⑤.
点评 本题考查混合物、单质、化合物、氧化物的判别,了解常见物质的组成、抓住各概念的特征进行分析判断是解答此类题的关键.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
1.下列变化中,前者属于物理变化,后者属于化学变化的是( )
| A. | 干冰升华 钢铁生锈 | B. | 牛奶变酸 呼吸作用 | ||
| C. | 酒精挥发 玻璃破碎 | D. | 光合作用 蜡烛熔化 |
19.二氧化氮(NO2)是造成酸雨的一种气体,其中氮元素的化合价是( )
| A. | +4 | B. | +3 | C. | +2 | D. | +1 |
3.将一定质量的镁、铝、铁三种金属的混合物与足量的稀硫酸充分反应后,生成氢气2g,则原混合物质量不可能是( )
| A. | 18g | B. | 24 g | C. | 28 g | D. | 50 g |
10.小明同学在练习“金属的化学性质”实验操作时,将没有打磨的铝片放入试管中,加入稀盐酸,结果发现产生的气泡很慢,于是他想:铝与稀盐酸反应的速率受哪些因素影响呢?经过认真思考,小明认为铝与稀盐酸反应的速率与酸的浓度、反应的温度有关,如表是他设计的实验和记录的数据(每次实验用相同质量的铝片和足量的稀盐酸反应).请你根据表中的信息填空:
(1)没有打磨的铝片和稀盐酸反应慢的原因是,铝在常温下能和氧气反应,在表面形成一层致密的氧化铝薄膜,阻止了铝与稀盐酸接触.写出铝与稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑.
(2)小明设计实验组合①②的目的是探究稀盐酸的浓度对反应的影响;实验组合②③的目的是探究溶液的温度对反应速率的影响;本实验的结论是反应的温度越高反应越快.
(3)除了用铝片消失的时间来衡量反应的快慢,还可以用反应中冒出的气体的速率方法来衡量反应的快慢.
(4)小明将稀盐酸换成稀硫酸继续实验,发现铝丝和稀硫酸反应现象不明显.
【发现问题】为什么铝丝易与稀盐酸反应而难与稀硫酸反应呢?
【提出假设】Cl-的存在使酸和铝的反应容易进行.
【设计实验】如果你能帮助小明设计一个合理的实验来验证假设取两支试管,分别加入相同的铝丝,然后分别加入等量的稀硫酸,在其中一支试管中加入一定量的氯化钠溶液,观察到加入氯化钠的试管中产生气泡的速度大,说明Cl-的存在使酸和铝的反应容易进行.
| 实验 编号 | 温度 | 盐酸 浓度 | 铝片消失的时间/s |
| ① | 20℃ | 5% | 60 |
| ② | 20℃ | 10% | 42 |
| ③ | 40℃ | 10% | 30 |
(2)小明设计实验组合①②的目的是探究稀盐酸的浓度对反应的影响;实验组合②③的目的是探究溶液的温度对反应速率的影响;本实验的结论是反应的温度越高反应越快.
(3)除了用铝片消失的时间来衡量反应的快慢,还可以用反应中冒出的气体的速率方法来衡量反应的快慢.
(4)小明将稀盐酸换成稀硫酸继续实验,发现铝丝和稀硫酸反应现象不明显.
【发现问题】为什么铝丝易与稀盐酸反应而难与稀硫酸反应呢?
【提出假设】Cl-的存在使酸和铝的反应容易进行.
【设计实验】如果你能帮助小明设计一个合理的实验来验证假设取两支试管,分别加入相同的铝丝,然后分别加入等量的稀硫酸,在其中一支试管中加入一定量的氯化钠溶液,观察到加入氯化钠的试管中产生气泡的速度大,说明Cl-的存在使酸和铝的反应容易进行.
7.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图.每2分钟测量C装置中吸收到的由反应过程中产生的二氧化碳的质量,并记录前18分钟数据如表.(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)
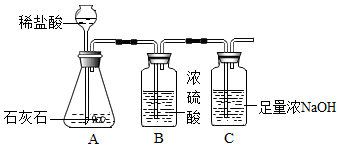
(1)B装置的作用是吸收水分,干燥气体.
(2)本实验测量石灰石中CaCO3的质量分数比实际石灰石中CaCO3的质量分数小.试分析可能原因是反应装置中生成的二氧化碳没有全部被排出.
(3)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由:2.40g,大理石碎屑生成的CO2质量是2.40g,而块状大理石和大理石碎屑的成分、质量相同..

| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
| 块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
(2)本实验测量石灰石中CaCO3的质量分数比实际石灰石中CaCO3的质量分数小.试分析可能原因是反应装置中生成的二氧化碳没有全部被排出.
(3)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由:2.40g,大理石碎屑生成的CO2质量是2.40g,而块状大理石和大理石碎屑的成分、质量相同..
8.现甲、乙两化学小组安装两套如图1装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素
(1)下列方法能检查该装置气密性的是AB
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(2)MnO2催化下下H2O2分解的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)甲小组有如下实验设计方案,完成如表.
(4)甲、乙两小组得出如图2数据
甲组实验得出的数据可知:浓度越大,H2O2分解速率越快;
由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下,H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用BaO2固体与硫酸溶液反应制H2O2(已知还生成硫酸钡沉淀),其化学反应方程式为BaO2+H2SO4=BaSO4↓+H2O2
支持这一方案的理由是过氧化氢在酸性环境下分解较慢

(1)下列方法能检查该装置气密性的是AB
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(2)MnO2催化下下H2O2分解的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)甲小组有如下实验设计方案,完成如表.
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
甲组实验得出的数据可知:浓度越大,H2O2分解速率越快;
由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下,H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用BaO2固体与硫酸溶液反应制H2O2(已知还生成硫酸钡沉淀),其化学反应方程式为BaO2+H2SO4=BaSO4↓+H2O2
支持这一方案的理由是过氧化氢在酸性环境下分解较慢

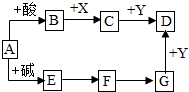 如图是初中化学中常见物质的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态.试回答下列问题.
如图是初中化学中常见物质的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态.试回答下列问题.