题目内容
3.将一定质量的镁、铝、铁三种金属的混合物与足量的稀硫酸充分反应后,生成氢气2g,则原混合物质量不可能是( )| A. | 18g | B. | 24 g | C. | 28 g | D. | 50 g |
分析 根据反应的化学方程式及其反应物、生成物的质量关系可以判断相关方面的问题.
解答 解:镁、铝、铁和稀硫酸反应的化学方程式及其反应物、生成物质量关系为:
Mg+H2SO4═MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2,Fe+H2SO4═FeSO4+H2↑,
24 2 54 6 56 2
由质量关系可知,生成2g氢气需要镁的质量是24g,需要铝的质量是18g,需要铁的质量是56g,如果镁、铝、铁三种金属的混合物与足量的稀硫酸充分反应后,生成氢气2g,则原混合物质量不可能是18g,
故选:A.
点评 如果物质全部是铝,18g铝能和足量稀硫酸反应生成2g氢气,如果是混合物,则18g混合物和足量稀硫酸反应生成的氢气质量小于2g,要注意理解.

练习册系列答案
相关题目
7.物质王国发生了一起团伙盗窃案,“警察”把三名“嫌疑犯”(分别是稀硫酸、氯化钠溶液和石灰水,)带回了“警察局”.上级派出下列四名“警察”分别去审问“他们”(即把“他们”鉴别出来).能完成任务的“警察”是( )
| A. | 硝酸银溶液“警察” | B. | 稀盐酸“警察” | ||
| C. | 无色酚酞试液“警察” | D. | 纯碱溶液“警察” |
8.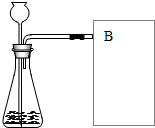 研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】H2O2 生成O2的快慢与催化剂种类有关
【实验方案】常温下,各取同质量、同浓度的H2O2 溶液,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】如图是他们进行实验的装置图,此实验中B处收集氧气的方法是排水法.
【实验记录】
【结论】比较数据你得出的结论是相同条件下H2O2生成O2的快慢与催化剂的种类有关.
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证MnO2和水泥块在化学反应前后的质量和化学性质是否发生改变.
分解H2O2 生成O2 的快慢与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响H2O2 生成O2 的快慢的因素以及相关假设和实验方案)
【假设】过氧化氢溶液的质量分数可能影响化学反应的速率.
【实验方案】同温下取2份质量相等,质量分数不同的H2O2溶液,分别加入质量相等的同种催化剂,测量收集一试管气体所需的时间.
 研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:【假设】H2O2 生成O2的快慢与催化剂种类有关
【实验方案】常温下,各取同质量、同浓度的H2O2 溶液,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】如图是他们进行实验的装置图,此实验中B处收集氧气的方法是排水法.
【实验记录】
| 实验编号 | 1 | 2 |
| 反应物 | 5%H2O2 | 5%H2O2 |
| 催化剂 | 1g水泥块 | 1gMnO2 |
| 时间 | 165秒 | 46秒 |
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证MnO2和水泥块在化学反应前后的质量和化学性质是否发生改变.
分解H2O2 生成O2 的快慢与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响H2O2 生成O2 的快慢的因素以及相关假设和实验方案)
【假设】过氧化氢溶液的质量分数可能影响化学反应的速率.
【实验方案】同温下取2份质量相等,质量分数不同的H2O2溶液,分别加入质量相等的同种催化剂,测量收集一试管气体所需的时间.
15.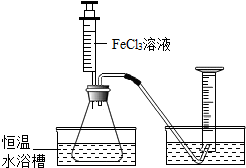 FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
【定性探究】分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,可通过观察产生气泡的快慢来定性比较两者的反应速率.
【定量探究】为进一步判断上述实验结论的准确性,小刚同学进行了如下实验方案设计.如图所示.
【方案一】在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
【方案二】在不同过氧化氢浓度下,测定相同时间收集气体体积的多少.
方案二的实验测量结果:
表中x=3,y=5.
实验结论:通过测量,若V1>V2(填“>”、“=”或“<”),说明在其他条件相同的情况下过氧化氢溶液浓度越大反应速率越快.
 FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.【定性探究】分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,可通过观察产生气泡的快慢来定性比较两者的反应速率.
【定量探究】为进一步判断上述实验结论的准确性,小刚同学进行了如下实验方案设计.如图所示.
【方案一】在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
【方案二】在不同过氧化氢浓度下,测定相同时间收集气体体积的多少.
方案二的实验测量结果:
| 序号 | H2O2溶液的体积/mL | H2O2溶液的浓度/% | 2%FeCl3溶液的体积/mL | 反应的时间/min | 生成O2的体积m/L |
| 1 | 10 | 30 | x | 5 | V1 |
| 2 | 10 | 15 | 3 | y | V2 |
实验结论:通过测量,若V1>V2(填“>”、“=”或“<”),说明在其他条件相同的情况下过氧化氢溶液浓度越大反应速率越快.
12. 小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
(1)对二氧化锰在过氧化氢分解反应中的作用,下列分析正确的是B.
A.二氧化锰能使过氧化氢分解产生的氧气总质量增加
B.二氧化锰能使过氧化氢分解速度变大,但是产生氧气总质量不变
C.二氧化锰能使过氧化氢分解速度变大,产生的氧气总质量变大
(2)研究催化剂的某些因素对过氧化氢分解速率的影响
实验一:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).
测定数据如下表所示:
①加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,该步操作的实验目的是控制催化剂中金属离子的数量相同,对比它们种类对过氧化氢分解的速率影响.
②根据上表数据得出的结论是铁离子对过氧化氢的催化效果强于铜离子.
实验二:从一块土豆的同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,将两份土豆同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.观察到两量筒内均有气泡生成,一段时间后,只有土豆片不断上升,而土豆块不能上浮.通过实验得出的结论是反应物和催化剂的接触面积越大,反应速率越快.
 小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.(1)对二氧化锰在过氧化氢分解反应中的作用,下列分析正确的是B.
A.二氧化锰能使过氧化氢分解产生的氧气总质量增加
B.二氧化锰能使过氧化氢分解速度变大,但是产生氧气总质量不变
C.二氧化锰能使过氧化氢分解速度变大,产生的氧气总质量变大
(2)研究催化剂的某些因素对过氧化氢分解速率的影响
实验一:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).
测定数据如下表所示:
| 时间/s 试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL 5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
②根据上表数据得出的结论是铁离子对过氧化氢的催化效果强于铜离子.
实验二:从一块土豆的同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,将两份土豆同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.观察到两量筒内均有气泡生成,一段时间后,只有土豆片不断上升,而土豆块不能上浮.通过实验得出的结论是反应物和催化剂的接触面积越大,反应速率越快.