题目内容
2.侯氏制碱法制得的纯碱(Na2CO3)中常含有少量氯化钠.某化学兴趣小组的同学拟测定某纯碱样品中Na2CO3的质量分数.
【方案一】沉淀分析法(如图1所示)则:
(1)“操作Ⅰ”的名称是过滤.
(2)溶液M中含有的阳离子有钠离子、钙离子.
(3)确定CaCl2溶液是否过量的方法是A.
A.取上层清液,滴加CaCl2溶液,如果无沉淀,则过量
B.向溶液M中滴加CaCl2溶液,如果有沉淀,则过量
(4)若沉淀A没有洗涤烘干,导致Na2CO3的质量分数偏大(填“偏大”、“偏小”或“不变”).判断沉淀A洗净的方法是:取最后一次洗涤所得滤液,滴加AgNO3溶液,若无(填“有”或“无”)白色沉淀,则洗涤干净.
(5)样品中Na2CO3的质量分数为$\frac{106n}{m}$%(用字母m、n的代数式表示).
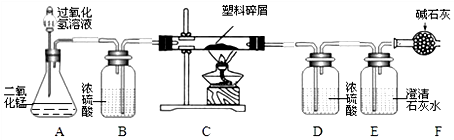
【方案二】气体分析法(如图2所示)
(1)A装置中反应的化学方程式为 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,盛稀硫酸的仪器名称为分液漏斗.
(2)通过称量C装置在反应前后的质量,即可求得产生二氧化碳的质量.
(3)理论上【方法二】比【方案一】会产生较大的误差,原因是空气中的二氧化碳和水蒸气能被C装置吸收.
分析 【方案一】
过滤能把固体和液体分离;
碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
氯离子能和银离子结合生成白色沉淀氯化银;
根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
(1)“操作Ⅰ”的名称是 过滤.
(2)溶液M中含有的阳离子有 钠离子、钙离子.
【方案二】
氢氧化钠固体能够吸收水蒸气和二氧化碳.
解答 解:【方案一】
(1)“操作Ⅰ”的名称是过滤.
故填:过滤.
(2)溶液M中含有的阳离子有钠离子和过量的钙离子.
故填:钠离子、钙离子.
(3)确定CaCl2溶液是否过量的方法是取上层清液,滴加CaCl2溶液,如果无沉淀,说明溶液中不含有碳酸钠,进一步说明氯化钙已经足量.
故填:A.
(4)若沉淀A没有洗涤烘干,会导致碳酸钙质量偏大,从而导致计算的碳酸钠质量偏大,进一步导致Na2CO3的质量分数偏大;
判断沉淀A洗净的方法是:取最后一次洗涤所得滤液,滴加AgNO3溶液,若无白色沉淀,说明滤液中不含有氯离子,则说明已经洗涤干净.
故填:偏大;无.
(5)设碳酸钠质量为x,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 100
x ng
$\frac{106}{x}$=$\frac{100}{ng}$,
x=$\frac{106}{100}$ng,
样品中Na2CO3的质量分数为:$\frac{106ng}{100mg}$×100%=$\frac{106n}{m}$%,
故填:$\frac{106n}{m}$%.
【方案二】
(1)盛稀硫酸的仪器名称是分液漏斗.
故填:分液漏斗.
(3)理论上【方法二】比【方案一】会产生较大的误差,原因是空气中的二氧化碳和水蒸气能被C装置吸收,导致计算的二氧化碳质量偏大,从而导致计算的碳酸钠质量分数偏大.
故填:空气中的二氧化碳和水蒸气能被C装置吸收.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


| A. | 甲图:测定空气中氧气的含量 | |
| B. | 乙图:验证化学反应前后质量守恒 | |
| C. | 丙图:验证燃烧需要空气(真空罩不影响传热) | |
| D. | 丁图:比较Zn、Cu、Ag的金属活动性 |
①2Na+--2个钠离子 ②O2--2个氧原子 ③2H2O--2个水分子 ④2H--2个氢元素 ⑤
 图中所示元素原子序数为20.
图中所示元素原子序数为20.| A. | ①④⑤ | B. | ②④ | C. | ①③⑤ | D. | ②③ |

| A. | 20℃时,A和C物质的溶解度相同 | |
| B. | 50℃时,50g水中最多溶解B物质的质量一定小于25g | |
| C. | A、B、C三种物质的溶液,都可以用蒸发溶剂的方法得到溶质固体 | |
| D. | 50℃时,A、B、C三种物质的饱和溶液各100g,分别降温到20℃,最后所得溶液的质量关系是A>C>B |
| A. | 铁丝受力弯曲,是因为力可以改变物体形状 | |
| B. | 汽油能除去油污,是因为发生乳化作用 | |
| C. | 硫酸钾可用作化肥,是因为其中含有氧元素 | |
| D. | 水的沸点能超过100℃,是因为水面的气压低于一标准大气压 |
| A. | 某些物质的导电性能: | B. | 地壳中部分元素的含量关系: | ||
| C. | 部分元素原子序数关系: | D. | 声在不同介质中的传播速度: |