题目内容
14.实验室常用如图所示是装置制取和收集气体.
(1)写出一个用A装置制取氧气的化学方程式.
(2)装置B、C可用于制取二氧化碳或氢气,写出制取气体的化学方程式(任写一个).采用D装置收集氢气时,气体从哪端进入?
(3)如何检验C装置的气密性?
分析 (1)A装置是加热固体制取氧气,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,据反应原理书写方程式;
(2)据制取氢气或 二氧化碳的反应原理书写方程式,氢气密度比空气小,应从短管进气,将空气挤压到集气瓶底部排出;
(3)据检查装置气密性的方法解答.
解答 解:(1)A装置是加热固体制取氧气,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,反应的化学方程式为:2KMnO4
| ||
(2)实验室制取二氧化碳的反应物是大理石和盐酸,大理石的主要成分是碳酸钙,二者反应的生成物是氯化钙、水、二氧化碳,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;制取氢气用锌和稀硫酸混合,反应方程式是:Zn+H2SO4=ZnSO4+H2↑;氢气密度比空气小,应从短管进气,将空气挤压到集气瓶底部排出;
(3)检查C发生装置气密性的方法是:关闭活塞,向长颈漏斗中注水至形成一段液柱,一段时间后若液柱不下降,即可证明装置不漏气;
故答案为:(1)2KMnO4
| ||
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;(或Zn+H2SO4=ZnSO4+H2↑);b;
(3)关闭活塞,向长颈漏斗中注水至形成一段液柱,一段时间后若液柱不下降,即可证明装置不漏气.
点评 本题主要考查了学生对实验室制取氧气、氢气、二氧化碳的反应原理、气密性检查、装置选取等知识的考查,了解相关知识是解答问题的关键.

练习册系列答案
相关题目
4.一定条件下密闭容器内发生了化学反应,反应前后各物质的质量变化如表所示,下列说法错误的是( )
| 物质 | A | B | C | D |
| 反应前的质量(克) | 17 | 64 | 2 | 0 |
| 反应后的质量(克) | m | 0 | 46 | 36 |
| A. | m=1 | B. | 反应生成的C与D的质量比为11:9 | ||
| C. | 该反应一定属于化合反应 | D. | 该反应可表示为:A+B→C+D |
5.几年前,广西河池宜州市境内龙江河发生了镉浓度超标事件.根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动顺序的探究及镉污染事故处理方法的研讨活动.
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价;
②水体中镉元素通常以氯化镉的形式存在;
③氯化镉能溶于水,氢氧化镉难溶于水.
(一)金属镉与铜、银活动性顺序的探究
实验结论:活动性顺序:镉>铜>银
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为CdCl2+2NaOH═Cd(OH)2↓+2NaCl.小敏认为该方案虽然有效,但有缺陷,原因是烧碱具有强腐蚀性.受小聪与小敏启发,你认为可以用熟石灰(写俗称)代替烧碱.
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价;
②水体中镉元素通常以氯化镉的形式存在;
③氯化镉能溶于水,氢氧化镉难溶于水.
(一)金属镉与铜、银活动性顺序的探究
| 实验步骤 | 实验现象 | 实验结论 |
| 分别取适量镉、铜、银于试管中,加入足量稀盐酸 | 镉表面有气泡产生,铜、银表面无气泡产生 | 镉的活动性顺序大于铜与银 |
| 取适量铜于试管中,加入少量硝酸银溶液 | 铜表面析出了一层银白色物质, 溶液由无色变为蓝色. | 铜的活动性顺序大于银 |
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为CdCl2+2NaOH═Cd(OH)2↓+2NaCl.小敏认为该方案虽然有效,但有缺陷,原因是烧碱具有强腐蚀性.受小聪与小敏启发,你认为可以用熟石灰(写俗称)代替烧碱.
9.下列除去少量杂质的方法正确的是( )
| A. | CO2气体(CO):点燃 | |
| B. | MnO2固体(KCl):加水过滤 | |
| C. | Zn粉中含少量的ZnO:加足量稀H2SO4,充分反应后过滤 | |
| D. | Na2CO3溶液中含少量Na2SO4:加入足量Ba(OH)2,充分反应后过滤 |
19.类推是学习过程中常用的思维方法,以下类推结果中正确的是( )
| A. | 因为碱溶液通常呈碱性,所以碱性溶液一定是碱的溶液 | |
| B. | 因为金属铝与稀盐酸反应生成AlCl3和H2,所以金属铁与稀盐酸反应生成FeCl3和H2 | |
| C. | 因为甲烷含碳元素和氢元素,其燃烧产物为二氧化碳和水,乙醇燃烧产物也为二氧化碳和水,所以乙醇中一定也含碳元素和氢元素 | |
| D. | 因为中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
6.某兴趣小组同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验:
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是4.4g.
(2)该石灰石样品的纯度是否符合要求?(该石灰石样品中杂质不与盐酸反应也不溶于水)
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 | 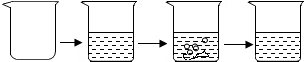 | |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中剩余混合物的质量为107.6g |
(1)该实验中生成的二氧化碳的质量是4.4g.
(2)该石灰石样品的纯度是否符合要求?(该石灰石样品中杂质不与盐酸反应也不溶于水)
3.下列实验操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |

 人类的日常生活和工农业生产离不开水,请回答:
人类的日常生活和工农业生产离不开水,请回答:
