题目内容
10. 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
(1)实验准备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
CaCl2+2NaOH═Ca(OH)2↓(微溶)+2NaCl
2NaHCO3(溶液)$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
NaHCO3+HCl═NaCl+H2O+CO2↑
Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O
②前期实验:
用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 产生气泡 | Ⅰ | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
Ⅱ的现象为有沉淀产生.
(2)实验过程
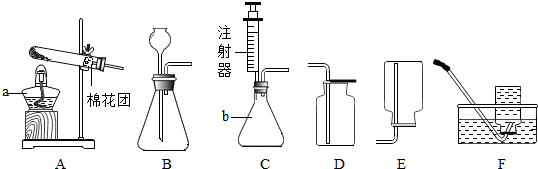
【实验1】证明NaOH溶液与NaHCO3溶液反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀.为了证明有Na2CO3生成,需要继续进行的操作是:取少量反应后的滤渣加入足量的取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有,若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明NaOH溶液与NaHCO3溶液反应后NaHCO3不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液进行取少量反应后的溶液加热至沸腾(填操作),将产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明有NaHCO3存在,反之则没有.
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从不同的角度证明反应的发生,比如:一是可以通过反应物检验证明反应发生;二是可以通过产物检验证明反应发生.
分析 (1)②根据稀盐酸和碳酸氢钠反应生成二氧化碳气体及氢氧化钙和碳酸钠反应生成氢氧化钠和碳酸钙进行解答;
(2)【实验1】观察图表,根据碳酸氢钠和氯化钙反应无明显现象和氯化钙与氢氧化钠反应生成不溶物进行解答;
【实验2】根据碳酸氢钠受热分解生成二氧化碳气体进行解答;
(3)通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是:一是可以通过检验反应物证明反应发生;二是可以通过检验产物证明反应发生.
解答 解:(1)Ⅰ稀盐酸和氢氧化钠反应生成氯化钠和水,反应的方程式为:HCl+NaOH═NaCl+H2O;Ⅱ氢氧化钙和碳酸钠反应生成氢氧化钠和碳酸钙沉淀,所以反应现象为:有沉淀产生;故答案为:HCl+NaOH═NaCl+H2O;有沉淀产生;
(2)【实验1】由表知,碳酸氢钠和氯化钙反应无明显现象,加入氢氧化钠,碳酸氢钠与氢氧化钠反应生成碳酸钠,碳酸钠与氯化钙反应生成沉淀;又由表知,氯化钙与氢氧化钠反应生成氢氧化钙,氢氧化钙是微溶物,在溶液中也产生沉淀;为证明溶液中有生成的碳酸钠,可以加入适量的稀盐酸,如有气泡产生,则有,否则无;故答案为:CaCl2;CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀;取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有;
【实验2】因为碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,所以把反应后的溶液加热,用澄清的石灰水检验有没有二氧化碳即可,故答案为:取少量反应后的溶液加热至沸腾;
(3)通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是:一是可以通过检验反应物证明反应发生;二是可以通过检验产物证明反应发生.
故填:反应物;产物.
点评 此题考查学生结合图表分析问题解决问题的综合能力,(2)问不太好想,如果够细心,仔细观察图表,结合这些信息加以分析,应该能得到一些启示.

 阅读快车系列答案
阅读快车系列答案| A. | 化学与安全:重金属中毒--喝鲜牛奶、豆浆等解毒;煤气泄漏--关闭气阀,严禁烟火 | |
| B. | 化学与生活:水中有异味--用活性炭吸附;鉴别纯棉织物和纯毛织物--灼烧闻气味 | |
| C. | 物理性质与用途:O2可燃--气焊切割金属;纯碱能与盐酸反应--治疗胃酸过多 | |
| D. | 化学与材料:塑料、橡胶--都属于有机高分子材料;生铁、黄铜--都属于金属材料 |
| A. | 用布袋代替一次性塑料购物袋 | |
| B. | 多用电子邮箱、QQ等通讯工具 | |
| C. | 夏天为了更凉快,把室内空调温度设置到很低 | |
| D. | 提倡乘坐公共交通工具,骑自行车或者步行等出行方式 |
| A. | 用铁矿石炼铁 | B. | 干冰制造出舞台云雾 | ||
| C. | 用石灰浆抹墙 | D. | 用食醋除去热水瓶内胆壁上的水垢 |
| A. | 金刚石、石墨和C60物理性质差异很大--它们由不同种原子构 | |
| B. | 6000L氧气加压下可装入容积为40L的钢瓶中--分子之间有间隔 | |
| C. | 稀有气体可作保护气--原子核外电子达到相对稳定结构 | |
| D. | NaOH和Ca(OH)2化学性质相似--电离时生成的阴离子都是OH- |
| 选项 | A | B | C | D |
| 课外实验 |  |  |  |  |
| 实验结论 | 说明蜡烛含有炭黑 | 说明有些花的色素可做酸碱指示剂 | 说明小苏打和酸反应生成二氧化碳 | 说明组成蛋壳的物质里含有碳酸根 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙醇 酒精 CH3COOH | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钙 熟石灰 CaO | D. | 氢氧化钠 火碱 NaOH |