题目内容
17.将一定量的锌放入烧杯中,加入一定量的稀硫酸,恰好完全反应,产生0.4g气体,反应后所得溶液的溶质的质量分数为20%.计算反应前稀硫酸中溶质的质量分数.分析 锌与稀硫酸反应生成硫酸锌和氢气,由生成氢气的质量,由反应的化学方程式列式计算出生成硫酸锌的质量、参加反应的硫酸的质量、参加反应的锌的质量,进而计算出反应前稀硫酸中溶质的质量分数.
解答 解:设生成硫酸锌的质量为x,参加反应的硫酸的质量为y,参加反应的锌的质量为z,
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
z y x 0.4g
$\frac{161}{2}=\frac{x}{0.4g}$ x=32.2g
$\frac{98}{2}=\frac{y}{0.4g}$ y=19.6g
$\frac{65}{2}=\frac{z}{0.4g}$ z=13g
生成硫酸锌溶液的质量为32.2g÷20%=161g.
反应前稀硫酸中溶质的质量分数为$\frac{19.6g}{161g+0.4g-13g}$×100%≈13.2%.
答:反应前稀硫酸中溶质的质量分数为13.2%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
8.下列变化属于化学变化的是( )
| A. |  石油分馏 石油分馏 | B. |  净化水 | ||
| C. |  蒸发食盐水 | D. |  铁丝燃烧 |
5.KNO3和NaCl在不同温度时的溶解度如下表:
请回答下列问题:
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图1,图中能表示KNO3溶解度曲线的是A(填“A”或“B”);
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的取值范围是20℃~30℃;
(3)某兴趣小组做了以下实验(如图2):
上述实验过程中得到的溶液一定属于不饱和溶液的是①③④(填数字序号).
将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体59.1g,所得滤液中KNO3的溶质质量分数为17.3%.(计算结果保留小数点后1位,不考虑实验过程中水的蒸发)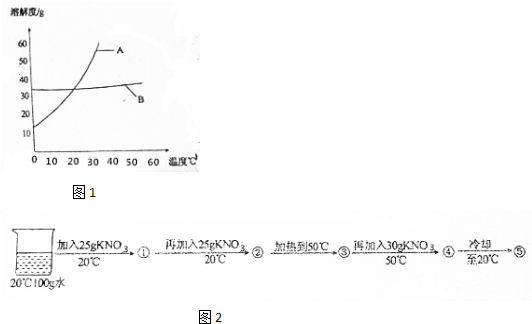
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图1,图中能表示KNO3溶解度曲线的是A(填“A”或“B”);
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的取值范围是20℃~30℃;
(3)某兴趣小组做了以下实验(如图2):
上述实验过程中得到的溶液一定属于不饱和溶液的是①③④(填数字序号).
将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体59.1g,所得滤液中KNO3的溶质质量分数为17.3%.(计算结果保留小数点后1位,不考虑实验过程中水的蒸发)

6.正确的实验操作是科学探究成功的基础.下列操作中正确的是( )
| A. |  滴瓶滴管使用 滴瓶滴管使用 | B. |  塞紧橡皮塞 塞紧橡皮塞 | C. |  测量溶液的PH 测量溶液的PH | D. |  闻气体气味 闻气体气味 |

 如图为某医用葡萄糖注射液标签的一部分.
如图为某医用葡萄糖注射液标签的一部分. 欲测定一瓶标签破损的稀硫酸的溶质质量分数.现取10g稀硫酸样品,将溶质质量分数为5%的氢氧化钠溶液逐滴加入到样品中,进行了数字化实验,边加边搅拌,随着氢氧化钠溶液加入,计算机描绘出了整个实验过程中溶液pH的变化图象(如图所示).
欲测定一瓶标签破损的稀硫酸的溶质质量分数.现取10g稀硫酸样品,将溶质质量分数为5%的氢氧化钠溶液逐滴加入到样品中,进行了数字化实验,边加边搅拌,随着氢氧化钠溶液加入,计算机描绘出了整个实验过程中溶液pH的变化图象(如图所示).