题目内容
11.某小组的同学用如图所示装置对氧化铁粉末(含少量铁粉)样品进行实验,图中铁架台等装置已略去.请回答:
(1)小组同学在实验操作时,应注意加热前先通一会儿氢气,目的是排尽空气,防止加热时发生爆炸.
(2)请完成表格.(H2的化学性质与CO相似):
| 实验现象 | 化学方程式 |
| A中反应产生大量气泡; | A中:Zn+H2SO4═ZnSO4+H2↑. |
| B中红色粉末逐渐变黑色; | B中:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2. |
| 反应前 | 氧化铁完全反应后 | |
| ①组 | B:玻璃管质量32.4g,氧化铁样品的质量10.0g | B:玻璃管和管内固体物质的质量40.0g |
| ②组 | C:干燥管和生石灰质量40.Og | C:干燥管和管内固体物质的质量43.0g |
(4)问题和讨论:经讨论,同学们对装置进行了改进,在AB(填2个装置代号)之间增加了如图所示的D装置,再次实验后,用得到的两组数据求出的样品中氧化铁的质量分数基本相同.
图D装置里的液体是浓硫酸.
分析 (1)氢气易燃易爆,实验开始先通氢气;实验结束后,为防止铁被氧化,停止加热后还要通入氢气.
(2)由图可知,氢气与氧化铁反应推断现象,则根据反应原理写出化学方程式;
(3)根据反应可知:氧化铜被氢气还原生成铜和水,故质量应该减少,可以据此作答;
(4)根据分析第二组实验结果大于氧化铜的原因可能是反应带出了部分水,使质量增加,故只要加入一个干燥装置即可.
解答 解:(1)实验开始时,先通入氢气,待试管中的空气被排净后,再给氧化铁加热,以防试管内的混合气体受热发生爆炸;实验结束时,先熄灭酒精灯,待试管冷却后,再停止通氢气,目的是使还原出来的铁在氢气环境下冷却,防止空气进入试管中致使灼热的铁被再度氧化,导致实验失败.
(2)氢气与氧化铁反应生成铁粉,B中红色粉末逐渐变黑色;方程式为:Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O.
(3)第二组实验结果大于氧化铜的原因可能是反应带出了部分水,使质量增加,使得计算结果不准确;所以选①组
根据氧化铜和氢气的反应可以知道:氧化铁中的氧元素和氢气中氢元素结合生成了水,所以固体的质量应该减少;
设:样品中氧化铁的质量为x.
Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O 固体减少
160 112 160-112=48
x 32.4g+10g-40g=2.4g
则$\frac{160}{x}=\frac{48}{2.4g}$,解得x=8.0g
样品中氧化铁的质量分数为:$\frac{8.0g}{10.0g}$×100%=80%;
(4)根据分析第二组实验结果大于氧化铜的原因可能是反应带出了部分水,使质量增加,所以应该在A和B之间加一个干燥装置;装置中加入浓硫酸.
故答案为:(1)排尽空气,防止加热时发生爆炸;
(2)红色;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(3)①;80%
(4)AB;浓硫酸.
点评 此题是一道综合题,解题的重点质量守恒定律等知识进行的计算,是一道能训练学生思维的综合题.

探究一 菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
(1)可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙.
(2)醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐.
【实验流程】如图1,

根据流程回答问题:
(1)操作①是过滤.
(2)加入足量CaCl2溶液的目的是将溶液中的草酸根和碳酸根完全沉淀出来.
(3)已知气体D能使澄清石灰水变浑浊,步骤③的化学反应方程式为CaCO3+2HAc=Ca(Ac)2+H2O+CO2↑.
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐.
探究二 人体结石的主要成分是草酸钙,草酸钙高温分解的产物是什么?
【查阅资料】
(1)草酸钙高温完全分解得到两种气态氧化物和一种固态氧化物.
(2)12.8g的草酸钙分解过程中温度与剩余固体的质量关系如图2所示.
【实验分析】
(1)草酸钙高温完全分解的化学方程式为CaC2O4$\frac{\underline{\;高温\;}}{\;}$CaO+CO↑+CO2↑.
(2)通过图2数据分析,700℃时剩余固体的成分是CaCO3和CaO.

请你设计实验,验证700℃时剩余固体的成分.
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体于试管中,加入适量的水,用手触摸试管壁;静置后取上层清液,滴加无色酚酞试液. 取不溶物于试管中,加入足量的稀盐酸,将气体通入澄清石灰水 | 试管壁发烫,溶液变红 有气泡冒出,澄清石灰水变浑浊. | 该固体中含有CaO. 该固体中含有CaCO3. 剩余固体的成分为CaO和CaCO3 |
| A. | 水结冰 | B. | 干冰升华 | C. | 点燃蜡烛 | D. | 矿石粉碎 |
| A. | 1 | B. | 2 | C. | 8 | D. | 5 |
【探究活动一】检验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因:CO2+Ca(OH)2═CaCO3↓+H2O.
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置,取少量上层清液,滴加1~2滴无色酚酞试液 | 该样品还含有氢氧化钙 |
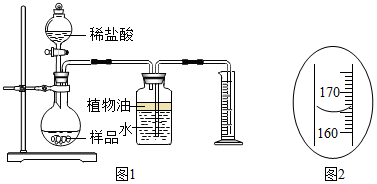
(3)当加入盐酸后其反应方程式为,反一段时间后,当观察到无气泡产生(填实验现象),才停止滴加稀盐酸.
(4)实验中量筒的作用是根据进入量筒内水的体积,测量生成的CO2的体积.
(5)实验结束后,量筒内进入水的体积如图2所示,其读数mL.已知在该实验条件下,生成气体的密度为2g•L-1,通过计算,样品中R的质量分数为25%
为
(6)上述图1所示实验装置和相关试剂,用来实验测定样品中R的质量分数是比较粗略的,请简要说明测定数据存在误差的原因:无法考虑盐酸加入后烧瓶内物质所占体积的变化对测定数据产生的影响(写一个).
(1)【提出问题】生成物中有哪几种碳的氧化物?
(2)【提出猜测】
| 猜测1 | 猜测2 | 猜测3 |
| 只有CO | 只有 CO2 | 含有CO和CO2 |
(4)【实验探究】
①观察到A装置(填序号)中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成;
②有两种实验现象都能分别证明草酸分解的气体中含有CO:
Ⅰ.C装置中澄清石灰水不变浑浊,F装置中澄清石灰水变浑浊:
Ⅱ.E装置中出现黑色粉末变成红色粉末的现象;
(5)【实验结论】通过实验探究证明:猜测3成立:草酸分解的化学方程式是C2H2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+H2O;
(6)【问题讨论】
①B装置的作用是检验二氧化碳是否被完全吸收,D装置的作用是吸收水分;
②装置末端酒精灯的作用是处理尾气CO.

| A. |  | B. |  | C. |  | D. |  |
