题目内容
2.某工厂的废液中含有硝酸银和硝酸亚铁,某同学取适量的上述废液样品,将一定质量的镁粉加入样品中,充分反应后过滤,得到滤渣和无色滤液,下列说法不正确的是( )| A. | 滤渣中至少含有两种金属 | |
| B. | 反应后得到滤渣的质量一定大于反应前加入的镁粉的质量 | |
| C. | 向滤渣中加入一定量稀盐酸,可能有气体生成 | |
| D. | 滤液中一定含有硝酸镁 |
分析 根据金属的性质进行分析解答,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换处理,据此解答.
解答 解:由于金属的活动性是:镁>铁>银,将镁粉加入到硝酸银、硝酸亚铁的混合物中,则镁首先与硝酸银反应生成了硝酸镁和银,当硝酸银完全反应后,再与硝酸亚铁反应,生成了硝酸镁和铁,由于得到的滤液为无色,则滤液中不含有硝酸亚铁.溶液中的银和铁全部置换出来,所以:
A、滤渣中至少含有银和铁两种金属,故A正确;
B、反应后得到银和铁,质量一定大于反应前加入的镁粉的质量,故B正确;
C、由于滤渣中含有铁,向滤渣中加入一定量稀盐酸,一定有气体生成,故C错误;
D、滤液中一定含有硝酸镁,故D正确.
故选C.
点评 本题考查的是常见的金属的性质,完成此题,可以依据已有的金属的性质以及金属活动性顺序的意义进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.化学与生活密切相关,下列对生活现象的解释不合理的是( )
| A. | 用3%的过氧化氢溶液进行伤口消毒时常看到有气泡产生,是因为H2O2分解产生了O2 | |
| B. | 压瘪的乒乓球放入热水重新鼓起,是因为球内的气体分子间隙大 | |
| C. | 灭火时将水喷成细雾状,主要目的是隔离氧气 | |
| D. | 野营篝火时通常将木柴架空,主要是增大木柴与空气的接触面积 |
10.除去下列物质中的少量杂质,所选用的试剂及操作方法 均正确的是( )
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CO2气体(CO) | 过量的氧气 | 点燃 |
| B | Fe2O3(Fe) | 足量的盐酸 | 过滤 |
| C | FeSO4溶液(CuSO4) | 足量的锌 | 过滤 |
| D | O2(H2O) | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
17.根据如图有关信息判断,下列说法错误的是( )
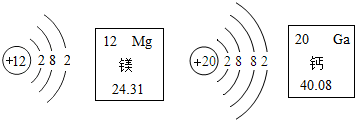

| A. | 镁元素的相对原子质量为12 | |
| B. | 在化学反应中,镁原子容易失去2个电子 | |
| C. | 在元素周期表中,镁元素和钙元素属于同一个族 | |
| D. | 钙离子核内有20个质子 |
19.将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化,再从剩余的浓海水中通过一系列工艺流程提取其他产品.
(1)海水提取镁的一段工艺流程如图:
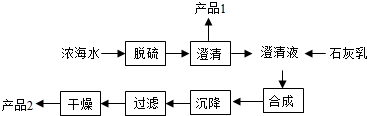
浓海水的主要成分如表:
该工艺流程中需要对海水进行脱硫,原理是用钙离子沉淀硫酸根离子,产品1为CaSO4,过滤后干燥的产品2为氢氧化镁,该反应方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;1L浓海水最多可得到产品2的质量为69.6g.
(2)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁与水在高温下反应生成碱与氢气,该反应的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(3)如图所示:海水经过晒盐后得到粗盐和苦卤,粗盐中还含有Ca2+、Mg2+、SO42-等可溶性杂质,以下是某化工厂进行粗盐提纯的示意图:
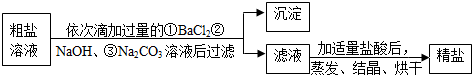
过量试剂①②③的顺序也可调整为②①③,过滤后可得到四种沉淀的化学式为Mg(OH)2、BaSO4、CaCO3、BaCO3;在利用粗盐制备精盐过程中,加入适量盐酸的目的是除去溶液中含有的NaOH,Na2CO3(填物质的化学式).
(4)利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
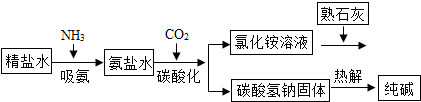
①氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水),氨盐水比食盐水更容易吸收二氧化碳,其原因是氨盐水显碱性;
②写出氯化铵溶液与熟石灰反应的化学方程式2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.
(1)海水提取镁的一段工艺流程如图:

浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(2)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁与水在高温下反应生成碱与氢气,该反应的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(3)如图所示:海水经过晒盐后得到粗盐和苦卤,粗盐中还含有Ca2+、Mg2+、SO42-等可溶性杂质,以下是某化工厂进行粗盐提纯的示意图:

过量试剂①②③的顺序也可调整为②①③,过滤后可得到四种沉淀的化学式为Mg(OH)2、BaSO4、CaCO3、BaCO3;在利用粗盐制备精盐过程中,加入适量盐酸的目的是除去溶液中含有的NaOH,Na2CO3(填物质的化学式).
(4)利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:

①氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水),氨盐水比食盐水更容易吸收二氧化碳,其原因是氨盐水显碱性;
②写出氯化铵溶液与熟石灰反应的化学方程式2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.
20.保持氧气化学性质的最小粒子是( )
| A. | 氧元素 | B. | 氧分子 | C. | 氧原子 | D. | 氧离子 |