题目内容
17.金属钠及其化合物广泛用于工农业及现实生活中,例如高纯度钠可作为原子反应堆的热载体,有些钠盐在日常生活中作调味品等.硬脂酸钠是肥皂的有效成分之一,其化学式是C17H35COONa.请回答下列问题.(1)硬脂酸钠中C、H、O的原子个数比是18:35:2.
(2)硬脂酸钠中H、O元素的质量比是35:32.
(3)若硬脂酸钠在水中发生反应:C17H35COONa+H2O═C17H35COOH+NaOH,其中C17H35COOH不溶于水,据此推测肥皂水pH>7(填“>”、“<”或“=”).
分析 (1)根据物质的化学式来分析;
(2)根据化合物中各元素质量比的计算方法来分析
(3)根据反应后生成物为氢氧化钠来分析
解答 解:(1)由硬脂酸钠的化学式C17H35COONa可知,一个硬脂酸钠分子中含有18个碳原子、35个氢原子、2个氧原子;故填:18:35:2
(2)硬脂酸钠中,碳元素与氧元素的质量比为:(1×35):(16×2)=35:32;故填:35::32
(3)氢氧化钠属于碱,其溶液显碱性PH大于7;>
(1)18:35:2 (2)35:32 (3)>
点评 准确地理解化学式的意义和计算方法是进行解答本题的关键

练习册系列答案
相关题目
8.观察如图,化石燃料在燃烧过程中会产生各种废气,其中形成酸雨的主要气体是( )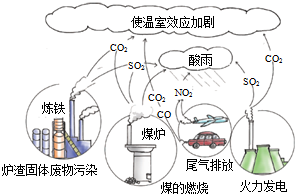

| A. | SO2、CO2 | B. | CO2、PM2.5 | C. | NO2、CO | D. | SO2、NO2 |
5.根据如图某反应的微观示意图得出的结论中,不正确的是( )


| A. | 该反应为复分解反应 | B. | 生成的C和D均为氧化物 | ||
| C. | 反应可表示为 A+2B$\frac{\underline{\;点燃\;}}{\;}$C+2D | D. | 生成C和D的质量比为11:9 |
2.铜镁合金具有优良的导电性,常用作飞机天线等导电材料.科研小组欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金10克放入烧杯,将140克稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量,数据记录如表.请计算:
(1)合金中镁与铜的质量比为13:7.
(2)4次实验中剩余固体减少量不相同的原因是第4次中硫酸没能完全反应.
(3)所加稀硫酸的溶质的质量分数.(写出计算过程)
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/克 | 35 | 35 | 35 | 35 |
| 剩余固体质量/克 | 9.1 | 8.2 | 7.3 | 6.5 |
(2)4次实验中剩余固体减少量不相同的原因是第4次中硫酸没能完全反应.
(3)所加稀硫酸的溶质的质量分数.(写出计算过程)
7.关注健康.预防疾病.下列叙述正确的是( )
| A. | 青少年每天需要摄入60g~70g蛋白质 | |
| B. | 纤维素是构成植物细胞的基础物质,它属于维生素 | |
| C. | 常量元素和一些微量元素能够调节人体的新陈代谢,促进身体健康,有的还是构成人体组织的重要材料 | |
| D. | 某人得了甲状腺肿大,应适当补充一些碘元素 |
 有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸.甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气.那么其中乙学生设计的装置比较合理.用较合理的装置制取氢气时,要使氢气充满收集氢气的试管,在不增减仪器的条件下,应该采取的措施是先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高.
有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸.甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气.那么其中乙学生设计的装置比较合理.用较合理的装置制取氢气时,要使氢气充满收集氢气的试管,在不增减仪器的条件下,应该采取的措施是先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高.
 实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品.某兴趣小组的同学对该样品的碳酸钠含量进行了探究.
实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品.某兴趣小组的同学对该样品的碳酸钠含量进行了探究.