题目内容
6.如果将一枚质量为12.8g的生锈的铁钉放入盛有87.2g稀硫酸的烧杯中,开始时铁钉表面的铁锈逐渐溶解,溶液由无色变成黄色,后来铁钉表面有气泡产生,溶液又逐渐变成浅绿色.如果等到铁钉完全和稀硫酸反应,称量烧杯中所得溶质量为99.6g,请你计算生锈的铁钉中单质铁的质量分数.分析 根据已有的知识进行分析,硫酸能与氧化铁反应生成硫酸铁和水,硫酸铁的水溶液为黄色,硫酸能与铁反应生成硫酸亚铁和氢气,硫酸亚铁的水溶液为浅绿色.
解答 解:溶液由无色变成黄色,后来铁钉表面有气泡产生,溶液又逐渐变成浅绿色,
硫酸能与铁反应生成硫酸亚铁和氢气,生成氢气的质量为:12.8+87.2-99.6=0.4g,
设生成0.4g氢气,需要xg铁,
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.4g
$\frac{56}{2}=\frac{x}{0.4g}$,
解得:x=11.2g,
生锈的铁钉中单质铁的质量分数为:$\frac{11.2g}{12.8g}×100%=87.5%$,
答:生锈的铁钉中单质铁的质量分数为87.5%;
故答案为:黄色;气泡;浅绿色.
点评 本题考查了硫酸与金属氧化物以及金属的反应,完成此题,可以依据已有的知识进行,要求同学们在平时的学习中加强基础知识的储备,以便灵活应用.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
16.碱具有一些相似的化学性质,这是因为( )
| A. | 碱能使指示剂变色 | B. | 碱能跟酸反应生成盐和水 | ||
| C. | 碱溶液能导电 | D. | 碱溶液中含有OH- |
17.某金属放入稀盐酸中,不产生气泡,该金属可能是 ( )
| A. | Mg | B. | Zn | C. | Fe | D. | Ag |
1.金属与化合物(盐)的溶液的反应
(1)学生动手完成课本第11页活动与探究实验.
(2)为什么要用砂纸打磨铝丝?除去氧化膜,利于观察和直接反应
(3)通过实验你能得出铝、铜、银的活动性顺序吗?铝>铜>银
(4)教师总结点拨酸的化学性质:①活泼金属与酸反应生成盐和氢气②酸能与碱发生中和反应生成盐和水 ③金属氧化物与酸反应生成盐和水.
(1)学生动手完成课本第11页活动与探究实验.
| 实验 | 现象 | 反应的方程式 | 反应类型 |
| 铝丝浸入硫酸铜溶液 | |||
| 铜丝浸入硝酸银溶液 | |||
| 铜丝浸入硫酸铝溶液 |
(3)通过实验你能得出铝、铜、银的活动性顺序吗?铝>铜>银
(4)教师总结点拨酸的化学性质:①活泼金属与酸反应生成盐和氢气②酸能与碱发生中和反应生成盐和水 ③金属氧化物与酸反应生成盐和水.
11.同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质
在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
请回答下列问题:
(1)表中X为58.
(2)当石灰石完全反应后,生成CO2的质量为22g.
(3)求该石灰石中CaCO3的质量分数,写出计算过程.
在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 58 | X | 58 |
(1)表中X为58.
(2)当石灰石完全反应后,生成CO2的质量为22g.
(3)求该石灰石中CaCO3的质量分数,写出计算过程.
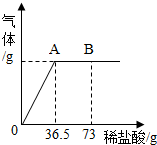 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算: A,B,C,D,E是常见的无色无味气体,X,Y,Z,W都是化合物,它们之间的转化关系如图所示,(图中略去部分反应产物),其中反应⑤是初中化学实验室制取气体E常用的方法.
A,B,C,D,E是常见的无色无味气体,X,Y,Z,W都是化合物,它们之间的转化关系如图所示,(图中略去部分反应产物),其中反应⑤是初中化学实验室制取气体E常用的方法.