题目内容
19.天然气的主要成分是甲烷(CH4),我校化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,请你参与:【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】含碳元素物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝.
【猜想与假设】甲 CO2 H2O; 乙 CO H2O;
丙 NH3CO2 H2O; 丁 CO2 CO H2O.
你认为丙同学的猜想一定是错误的.
【实验探究】为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置:
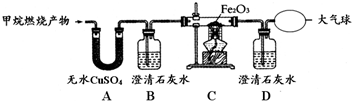
(1)A、B装置的顺序否(填“能”或“不能”)颠倒;
(2)实验中用纯净O2而不用空气的原因是空气中含有CO2和H2O(干扰对产物的鉴别);
(3)实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成黑色,由此推断丁同学猜想成立;
(4)请写出C中红色粉末变成黑色的化学方程式:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
【反思与交流】为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是:氧气充足.
分析 【猜想与假设】:根据质量守恒定律考虑;(1)根据颠倒后的后果考虑;(2)根据空气与纯净氧气的区别考虑;(3)根据无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成黑色分析出气体成分;(4)根据方程式的写法考虑;【反思与交流】根据促进可燃物燃烧的条件考虑.
解答 解:【猜想与假设】根据质量守恒定律可知化学反应前后元素的种类不变,反应物中是甲烷和氧气,不含有氮元素,生成物中不可能生成氨气,所以丙假设错误;
(1)如果顺序颠倒,由于石灰水中有水,就不能证明混合气体中是否有水;
(2)由于空气中含有水分和二氧化碳,用空气就无法验证混合气体中是否含有水和二氧化碳,因为到底是混合气体中的水和二氧化碳,还是空气中的水和二氧化碳,无法确定;
(3)A中无水CuSO4变蓝说明混合气体中有水,B中石灰水变浑浊说明混合气体中含有二氧化碳,B中石灰水有两个作用:验证二氧化碳的存在,除去二氧化碳;D中澄清石灰水变浑浊,C中红色粉末变成黑色说明具有还原性气体,且与氧化铁反应能生成二氧化碳,所以说明混合气体中含有一氧化碳;
(4)C中红色粉末变成黑色的反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,用得失氧进行配平,反应条件是高温,写在等号的上边.
【反思与交流】由于可燃物不完全燃烧能生成一氧化碳,污染环境,所以要让可燃物完全燃烧,所以需要充足的氧气.
故答案为:【猜想与假设】丙;
【实验探究】(1)否;
(2)空气中含有CO2和H2O(干扰对产物的鉴别);
(3)丁;(4)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
【反思与交流】氧气充足.
点评 解答本题的关键是要知道无水硫酸铜由白色变为蓝色说明有水生成,能使澄清石灰水变浑浊的气体是二氧化碳,还要知道一氧化碳与氧化铁反应生成铁和二氧化碳.

【提出问题】在一个门窗紧闭刚上完课的教室内空气中的二氧化碳的含量,与教室外操场上空气中二氧化碳的含量有什么不同?
【提出猜想】小明认为:刚下课的教室内空气中二氧化碳的含量应该比室外操场上空气中二氧化碳的含量高.
【查阅资料】当空气中二氧化碳超过正常含量时,会对人体产生有害的影响.
【实验探究】用 排水集气法分别收集教室内和操场上气体各一瓶进行如下探究实验:
| 实验操作 | 实验现象 | 结论 |
| 将澄清的石灰水分别滴入盛有教室内的空气和操场上的空气的集气瓶中 | 教室内的空气瓶中石灰水变浑浊;操场上的空气瓶中石灰水无明显变化. | 教室内的空气中二氧化碳含量比操场上的空气中高. |
(2)本实验中用排水法收集的方法在实验中具有应用价值,可用于我们收集实验室、仓库等位置的气体.如用此法收集仓库中的气体,你的实验操作是将集气瓶装满水,带进仓库内,将水倒出,盖上玻璃片.
【实验Ⅰ】小明取一定量白色粉末于烧杯中,加水搅拌,充分溶解后,过滤,得到固体和无色溶液.
【实验Ⅱ】小明取实验Ⅰ得到的固体于试管中,滴加足量稀盐酸后,观察到有有气泡(现象)产生,于是小明马上就得出结论,该瓶中白色粉末一定是碳酸钙,但是小军却认为小明的结论不一定正确,固体还可能是碳酸钠,你认为小军的理由是碳酸钠的溶解度小,也会出现不溶性固体,请你写出上述有气体生成的反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑(任写一个).
【实验Ⅲ】小明和小军认为有必要再对实验Ⅰ中滤液的成分进行探究,过程如下:
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量滤液于试管中,向其滴加2滴~3滴无色酚酞试液,振荡 | 溶液由无色变为红色 | 该瓶中白色粉末一定不是碳酸钙和氯化钠 |
| (2)另取少量滤液于试管中,滴加过量氯化钙溶液,振荡,静置 | 产生白色沉淀 | 该瓶中白色粉末一定有碳酸钠,涉及的化学方程式为Na2CO3+CaCl2=2NaCl+CaCO3↓ |
【试剂应用】某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性.这一定量石油产品中含H2SO4的质量是多少?
| A. | 2:3 | B. | 3:2 | C. | 2:1 | D. | 1:2 |
Ⅰ.定性探究
实验证明
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水放热 |
| ②向①所得的溶液中逐滴加入过量稀硝酸 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的 杂质是碳酸钠. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂 质是氯化钠 |
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:
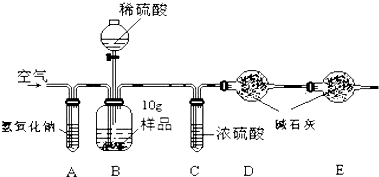
(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).
| A. |  送入药品 | B. |  存放氢气 | C. |  溶解固体 | D. |  稀释浓硫酸 |
