题目内容
16.下列是某同学鉴别二氧化碳和一氧化碳的方法,其中不正确的是( )| A | B | C | D | |
| 实验 方案 | 通过灼热的氧化铜 | 用燃烧的木条分别伸入集气瓶中 | 将气体分别通人盛水的烧杯中 | 将气体分别通人澄清石灰水中 |
| A. | A | B. | B | C. | C | D. | D |
分析 区别一氧化碳和二氧化碳两种无色气体,要求根据两种气体性质的不同,设计的方案能出现两种明显不同的实验现象,才能达到达到一次鉴别出两瓶气体的目的.
解答 解:A、将一氧化碳和二氧化碳分别通过灼热的氧化铜,能使黑色的氧化铜粉逐渐变成红色的气体是一氧化碳,无反应现象的是二氧化碳,所以此方法可以鉴别一氧化碳和二氧化碳.故不符合题意;
B、分别点燃一氧化碳和二氧化碳,能燃烧的是一氧化碳,不能燃烧的是二氧化碳,所以此方法可以鉴别一氧化碳和二氧化碳.故不符合题意;
C、二氧化碳能溶于水生成可溶性的碳酸,一氧化碳难溶于水,通入水后均无现象,故无法鉴别,符合题意;
D、将一氧化碳和二氧化碳分别通过澄清的石灰水,使澄清石灰水变浑浊的是二氧化碳气体,没有现象的是一氧化碳,所以此方法可以鉴别一氧化碳和二氧化碳.故不符合题意;
故选C.
点评 本题考查了常见气体的鉴别方法,解题的关键是利用所要鉴别气体的性质的差别,根据实验中是否出现明显的不同现象判断能否鉴别.

练习册系列答案
相关题目
6.某化学兴趣小组同学在回收废旧电池的同时,开展了如下的实验探究.
【查阅资料】废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.
【实验1】废干电池的拆卸与处理
(1)兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净,备用.
(2)将铜帽放入盐酸中,除去锈污,冲洗备用.
【实验2】检验废干电池筒内黑色固体中MnO2的存在
兴趣小组同学设计了如图所示的实验:
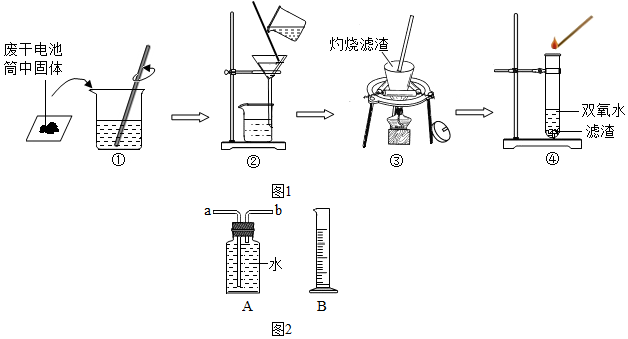
(1)操作②中过玻璃棒的作用是引流.
(2)引流操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊,该反应的化学表达式为CO2.
(3)操作④试管中产生的气体能使带火星木条复燃,该气体为O2
(4)由此得出结论:滤渣中黑色固体化学式为MnO2和C
【实验3】利用回收锌皮制取氢气及相关探究
(1)用锌皮和稀硫酸制取氢气.用适当的发生装置,采用排水法收集并测定氢气的体积(如图2),气体从装置A导管口b(填“a”或“b”) 进,选用仪器B测量排出水的体积,仪器B名称是量筒.
(2)探究影响锌与稀硫酸反应快慢的因素.反应过程中用前10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表4组实验,获得数据如下.
[数据分析]
①比较实验a和实验b得到的结论是:与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率大.
②为了研究硫酸浓度对反应快慢的影响,需比较实验a和c(填实验编号).
③探究影响该反应快慢的因素,还需控制的条件是:温度(或锌粒形状大小)(举一例即可).
【实验4】探究经处理干净的二氧化锰在氯酸钾分解反应中的催化作用
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热.
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体.
(3)再将残留固体经溶解、过滤、洗涤、干燥、称量,得到5.5g黑色固体.
[数据分析]
①该实验说明:二氧化锰在氯酸钾分解反应前后,质量不变.
②完全反应后制得氧气的质量是9.6g.(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后生成各生成物的质量总和)
[实验反思]
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较产生氧气速率的大小.
【查阅资料】废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.
【实验1】废干电池的拆卸与处理
(1)兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净,备用.
(2)将铜帽放入盐酸中,除去锈污,冲洗备用.
【实验2】检验废干电池筒内黑色固体中MnO2的存在
兴趣小组同学设计了如图所示的实验:

(1)操作②中过玻璃棒的作用是引流.
(2)引流操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊,该反应的化学表达式为CO2.
(3)操作④试管中产生的气体能使带火星木条复燃,该气体为O2
(4)由此得出结论:滤渣中黑色固体化学式为MnO2和C
【实验3】利用回收锌皮制取氢气及相关探究
(1)用锌皮和稀硫酸制取氢气.用适当的发生装置,采用排水法收集并测定氢气的体积(如图2),气体从装置A导管口b(填“a”或“b”) 进,选用仪器B测量排出水的体积,仪器B名称是量筒.
(2)探究影响锌与稀硫酸反应快慢的因素.反应过程中用前10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表4组实验,获得数据如下.
| 实验编号 | 试剂 | 前10 min内产生的 氢气体积(mL) | |
| 锌的纯度 | 稀硫酸的体积和浓度 | ||
| a | 纯锌 | 30 mL 30% | 564.3 |
| b | 含杂质的锌 | 30 mL 30% | 634.7 |
| c | 纯锌 | 30 mL 20% | 449.3 |
| d | 纯锌 | 40 mL 30% | 602.8 |
①比较实验a和实验b得到的结论是:与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率大.
②为了研究硫酸浓度对反应快慢的影响,需比较实验a和c(填实验编号).
③探究影响该反应快慢的因素,还需控制的条件是:温度(或锌粒形状大小)(举一例即可).
【实验4】探究经处理干净的二氧化锰在氯酸钾分解反应中的催化作用
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热.
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体.
(3)再将残留固体经溶解、过滤、洗涤、干燥、称量,得到5.5g黑色固体.
[数据分析]
①该实验说明:二氧化锰在氯酸钾分解反应前后,质量不变.
②完全反应后制得氧气的质量是9.6g.(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后生成各生成物的质量总和)
[实验反思]
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较产生氧气速率的大小.
7.“雾霾”成为2014年北京APEC会议期间空气质量改善的关键,从化学知识的角度,以下说法不正确的是( )
| A. | 雾霾的罪魁祸首是PM2.5,PM2.5产生原因之一是化石燃料燃烧和扬尘等 | |
| B. | PM2.5防护口罩使用了活性炭,这是利用了活性炭的吸附作用 | |
| C. | 少开私家车,多走路等措施能缓解雾霾天气 | |
| D. | 除雾霾外,人为大量排放CO2形成的酸雨也是一种空气污染现象 |
11.下列曲线正确的是( )
| A. |  向盐酸中不断加水 | B. |  向金属锌中加稀盐酸 | ||
| C. |  向Na2CO3溶液中加CaCl2 | D. |  氧气在水中溶解度 |
5.对比是学习化学的重要方法.下列关于CO2与CO的比较错误的是( )
| A. | 一个二氧化碳分子比一个一氧化碳分子多一个氧原子 | |
| B. | CO2可用于光合作用,CO可用于人工降雨 | |
| C. | CO2能溶于水,CO难溶于水 | |
| D. | CO2会造成温室效应,CO易与血液中的血红蛋白结合引起中毒 |
6.建立基本的化学观念可以让我们更好的理解化学,如形成守恒观念,可以更好的理解质量守恒定律,下列表述正确的是( )
| A. | 每1个C原子和1个O2分子反应,生成2个CO2分子 | |
| B. | 32g S与32g O2完全反应,生成64g SO2 | |
| C. | 镁条燃烧后固体质量增加,故质量守恒定律不是普遍规律 | |
| D. | 10g水蒸气变成10g水蒸气,变化前后质量相等,遵循质量守恒定律 |
 A-F是我们已经学习过的六种物质,其中B、C、E通常情况下是无色气体,A、D为黑色固体,A、E为单质,F为无色液体.它们之间的相互关系如图所示(“→”表示物质间的转化关系,“-”表示物质间可以相互反应).请回答:
A-F是我们已经学习过的六种物质,其中B、C、E通常情况下是无色气体,A、D为黑色固体,A、E为单质,F为无色液体.它们之间的相互关系如图所示(“→”表示物质间的转化关系,“-”表示物质间可以相互反应).请回答: A~I是初中化学常见的物质,他们之间的相互关系如图所示,其中B是红色固体,A、C常温下是气体.请回答下面问题:
A~I是初中化学常见的物质,他们之间的相互关系如图所示,其中B是红色固体,A、C常温下是气体.请回答下面问题: