题目内容
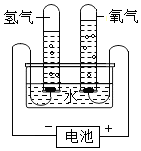
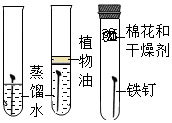
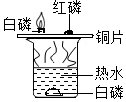
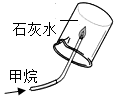
3.分类、类比是学习化学常用的有效方法.请回答:(1)初中化学教材中有很多实验,若按照实验目的不同来分类,可以将下表中的②③;①④(填字母)归为一类,依据是:②③都是探究反应发生的条件;①④都是探究物质的性质.
 |  |  |  |
| ① | ② | ③ | ④ |
分析 (1)根据实验探究的目的来分析;
(2)根据钙与水反应生成氢氧化钙,氢氧化钙与氯化铵反应来分析.
解答 解:(1)①探究了水在通电的条件下能分解为氢气和氧气这一性质;②探究了铁的锈蚀条件;③探究了可燃物的燃烧条件;④探究了甲烷具有可燃性以及燃烧的产物这一性质;故填:②③都是探究反应发生的条件;①④都是探究物质的性质;
(2)钙能与水反应生成了氢气和氢氧化钙;氢氧化钙与氯化铵反应生成氯化钙、水和氨气,所以将金属钙投入氯化铵溶液中会观察到溶液中有气泡产生,并产生有刺激性的气味;发生的化学反应分别为:Ca+2H2O═Ca(OH)2+H2↑;Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,将两个化学方程式合并为:Ca+2NH4Cl═CaCl2+H2↑+2NH3↑.故填:产生刺激性气味;Ca+2NH4Cl═CaCl2+H2↑+2NH3↑.
点评 本题考查了实验探究的目的,活泼金属的化学性质,根据所学知识并结合题干信息就能顺利解答.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
14. 如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )
如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )
 如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )
如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )| A. | 物质C具有助燃性 | B. | 物质G的浓溶液一定具有挥发性 | ||
| C. | E→F的反应可能会产生大量气泡 | D. | H─G的反应为复分解反应 |
18.某校化学兴趣小组选用H2SO4与下表中的四种溶液进行复分解反应条件的实验探究.
(1)以上实验中,不能够发生复分解反应的是②(填序号);
(2)实验结束后,将上述废液倒入同一烧杯中,观察到有白色沉淀,过滤,取少量无色滤液进行如下探究:

综合上述反应,以及相关实验现象推断,无色滤液中一定含有的离子包括Cl-、Na+、OH-、Ba2+;
(3)下列有关利用实验(2)中无色滤液的设想中,合理的是C.
A.鉴别氯化镁溶液和硫酸镁溶液:取样,分别滴加少量无色滤液,观察现象
B.制取氯化钠溶液:向无色滤液中加入适量的碳酸钠溶液,充分反应后过滤
C.处理实验室中含有硫酸的废水:向含有硫酸的废水中加入适量的无色滤液.
| 组合序号 | ① | ② | ③ | ④ |
| 组合物质 | 稀硫酸 氢氧化钠溶液 | 稀硫酸 氯化钠溶液 | 稀硫酸 碳酸铵溶液 | 稀硫酸 氯化钡溶液 |
(2)实验结束后,将上述废液倒入同一烧杯中,观察到有白色沉淀,过滤,取少量无色滤液进行如下探究:

综合上述反应,以及相关实验现象推断,无色滤液中一定含有的离子包括Cl-、Na+、OH-、Ba2+;
(3)下列有关利用实验(2)中无色滤液的设想中,合理的是C.
A.鉴别氯化镁溶液和硫酸镁溶液:取样,分别滴加少量无色滤液,观察现象
B.制取氯化钠溶液:向无色滤液中加入适量的碳酸钠溶液,充分反应后过滤
C.处理实验室中含有硫酸的废水:向含有硫酸的废水中加入适量的无色滤液.
8.化学兴趣课上,同学们对过氧化钠(Na2O2)可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动.
【提供资料】①二氧化碳与过氧化钠反应生成氧气和另一种物质.
②Na2O2是一种淡黄色固体,常温下能与H2O、HCl气体等物质发生反应,生成氧气不能与N2发生反应.
(1)探究二氧化碳与过氧化钠反应生成氧气.
同学们在老师的指导下设计了如图所示装置.

①写出检验G中气体的方法将带火星木条伸入集气瓶中,若木条复燃,证明气体为氧气.
②若无装置C,对实验有影响的物质是H2O.
③若观察到装置F不变浑浊,说明二氧化碳已经除尽.
(2)探究二氧化碳与过氧化钠反应生成的另一种物质.
【猜想与假设】下面是同学们提出的3种猜想.
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
你认为猜想1、2是不正确的,理由是参加反应的物质中不含氢元素,不可能生成氢氧化钠或碳酸氢钠.
【进行实验】排除错误猜想后,同学们通过以下实验验证了另一种物质.
【反思与评价】
①某同学认为上述方案存在不足,他的理由是二氧化碳与过氧化钠反应后的固体中可能含有未反应完的过氧化钠,与盐酸反应也会有气泡产生,不能证明固体中有碳酸钠.
②写出过氧化钠与二氧化碳反应的化学方程式2CO2+2Na2O2=O2+2Na2CO3.
【提供资料】①二氧化碳与过氧化钠反应生成氧气和另一种物质.
②Na2O2是一种淡黄色固体,常温下能与H2O、HCl气体等物质发生反应,生成氧气不能与N2发生反应.
(1)探究二氧化碳与过氧化钠反应生成氧气.
同学们在老师的指导下设计了如图所示装置.

①写出检验G中气体的方法将带火星木条伸入集气瓶中,若木条复燃,证明气体为氧气.
②若无装置C,对实验有影响的物质是H2O.
③若观察到装置F不变浑浊,说明二氧化碳已经除尽.
(2)探究二氧化碳与过氧化钠反应生成的另一种物质.
【猜想与假设】下面是同学们提出的3种猜想.
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
你认为猜想1、2是不正确的,理由是参加反应的物质中不含氢元素,不可能生成氢氧化钠或碳酸氢钠.
【进行实验】排除错误猜想后,同学们通过以下实验验证了另一种物质.
| 实验操作 | 实验现象 |
| 取少量CO2与Na2O2反应后的固体于试管中,加入稀盐酸. | 有大量气泡产生 |
①某同学认为上述方案存在不足,他的理由是二氧化碳与过氧化钠反应后的固体中可能含有未反应完的过氧化钠,与盐酸反应也会有气泡产生,不能证明固体中有碳酸钠.
②写出过氧化钠与二氧化碳反应的化学方程式2CO2+2Na2O2=O2+2Na2CO3.
12.Ⅰ.下列是实验室制取气体的一些装置图,请根据要求回答:
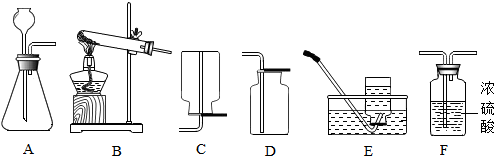
(1)实验室用高锰酸钾做原料制氧气的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;可选用的发生装置是B(填字母序号).
(2)实验室制取并收集一瓶干燥的二氧化碳气体,化学反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.按照气流自左至右方向流动,所用仪器按连接顺序依次为AFD(填字母顺序).
(3)实验室若用5%的过氧化氢溶液与二氧化锰混合来制取氧气.要配制5%的过氧化氢溶液600g,需要质量分数为30%的过氧化氢溶液(密度为1.1g/cm3)90.9mL(计算结果保留一位小数).稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签.
Ⅱ.下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:
(l)上述实验设计中有错误的是AB(填字母序号);A中可燃物应取过量的原因是可将装置中的氧气耗尽.
(2)B中玻璃棒的作用是搅拌,使产生的热量迅速扩散(加快散热);C中会出现的实验现象为铁钉生锈,U型管液面左高右低.
(3)D中硬质玻璃管内发生反应的化学方程式为3CO+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,酒精灯的作用是点燃尾气中的CO,防止污染环境.

(1)实验室用高锰酸钾做原料制氧气的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;可选用的发生装置是B(填字母序号).
(2)实验室制取并收集一瓶干燥的二氧化碳气体,化学反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.按照气流自左至右方向流动,所用仪器按连接顺序依次为AFD(填字母顺序).
(3)实验室若用5%的过氧化氢溶液与二氧化锰混合来制取氧气.要配制5%的过氧化氢溶液600g,需要质量分数为30%的过氧化氢溶液(密度为1.1g/cm3)90.9mL(计算结果保留一位小数).稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签.
Ⅱ.下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:
| A | B | C | D |
| 测定空气中氧气的含量 | 稀释浓硫酸 | 铁钉在空气中的变化 | 一氧化碳还原氧化铁 |
木炭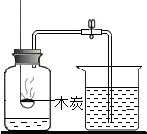 | 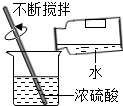 | 水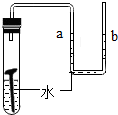 | 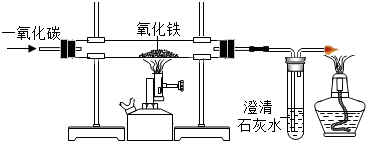 |
(2)B中玻璃棒的作用是搅拌,使产生的热量迅速扩散(加快散热);C中会出现的实验现象为铁钉生锈,U型管液面左高右低.
(3)D中硬质玻璃管内发生反应的化学方程式为3CO+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,酒精灯的作用是点燃尾气中的CO,防止污染环境.
13.如图实验操作不正确的是( )
| A. |  | B. |  | C. |  | D. |  |

