题目内容
2.目前,教科书中测定空气里氧气含量的方法,无法满足严谨的科学要求,利用NO和氢氧化钠溶液可以更准确地测定空气中O2的含量.【查阅资料】①NO是一种无色无味,难溶于水的有毒气体.相同条件下,2体积的NO与1体积的O2完全反应,生成2体积的NO2(化学方程式为:2NO+O2═2NO2)
②氢氧化钠溶液吸收NO2生成NaNO2、NaNO3和H2O
③2FeSO4+3H2SO4+2NaNO2═Fe2(SO4)3+2NaHSO4+2H2O+2NO↑
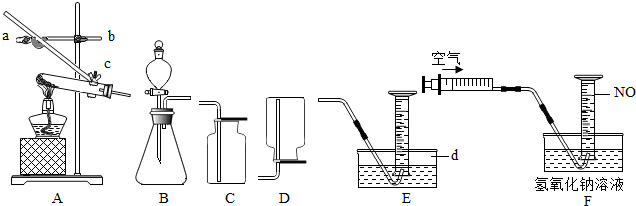
(1)写出仪器d的名称:水槽;
(2)若要调节A中试管与酒精灯相对高度,应调节螺旋b(填“a”、“b”或“c”).
(3)写出氢氧化钠溶液吸收NO2反应的化学方程式:2NaOH+2NO2=NaNO2+NaNO3+H2O.
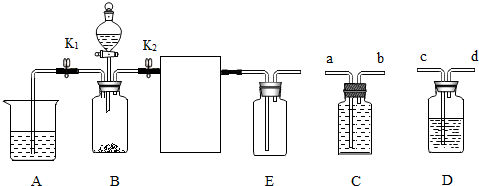
(4)实验室用稀硫酸、NaNO2饱和溶液和FeSO4•7H2O固体反应制备NO,应选用的发生装置是B(填序号).用E装置收集纯净的NO气体,而不用C或D装置的理由是:一氧化氮能与氧气反应且密度与空气接近.
(5)如图F所示,向收集有60mLNO气体的量筒中,缓慢推入20mL的空气,用橡胶塞塞住量筒口,小心混合,使气体充分反应.1~2min后,在液面下移开橡胶塞.2min后,观察和记录最终量筒中气体的体积为67.4mL.则20mL空气中含氧气4.2mL,操作时存在的主要安全隐患氢氧化钠溶液对皮肤具有腐蚀性.
(6)收集60mLNO气体(密度约为1.27g/L),至少需要固体NaN02的质量是多少?(请写出计算过程,计算结果精确到0.01g)
分析 据图即可知道有关仪器的名称;根据反应的化学方程式的书写方法书写反应的化学方程式;根据气体的性质确定收集气体的方法;根据测定氧气含量的方法以及氢氧化钠的腐蚀性解答,根据反应的化学方程式结合数据计算即可.
解答 解:(1据图可以看出,仪器d是水槽,故填:水槽;
(2)若要调节A中试管与酒精灯相对高度,应调节螺旋b,故填:b;
(3)氢氧化钠溶液吸收NO2反应生成亚硝酸钠、硝酸钠和水,故填:2NaOH+2NO2=NaNO2+NaNO3+H2O.
(4)实验室用稀硫酸、NaNO2饱和溶液和FeSO4•7H2O固体反应制备NO,是固液常温型反应,应选用的发生装置是B;用E装置收集纯净的NO气体,而不用C或D装置是因为一氧化氮能与氧气反应且密度与空气接近.故填:B;一氧化氮能与氧气反应且密度与空气接近;
(5)2NO+O2═2NO2
2 1 2
2NaOH+2NO2=NaNO2+NaNO3+H2O
减少的气体的体积为:60mL+20mL-67.4mL=12.6mL
氧气的体积占减少的气体体积的三分之一,故氧气的体积为:12.6mL×$\frac{1}{3}$=4.2mL;
由于氢氧化钠具有极强的腐蚀性,因此在实验中要注意氢氧化钠对皮肤的腐蚀性;
故填:4.2;氢氧化钠溶液对皮肤具有腐蚀性;
(6)60mL一氧化氮的质量为:60×10-3L×1.27g/L=0.08g
设至少需要亚硝酸钠的质量为x
2FeSO4+3H2SO4+2NaNO2═Fe2(SO4)3+2NaHSO4+2H2O+2NO↑
138 60
x 0.08g
$\frac{138}{60}=\frac{x}{0.08g}$ x=0.18g
答:至少需要固体亚硝酸钠的质量为0.18g.
点评 本题为信息给予题,完成此题,要善于从题干中提取有用的信息,然后根据学过的物质的性质进行分析推理即可.

| A. | 可用肥皂水区别硬水和软水 | |
| B. | H2O是由一个氢分子和一个氧原子构成 | |
| C. | H2O中氧元素的化合价为-2 | |
| D. | H2O是氧化物 |
| A. |  将锌片插入盛有一定量稀硫酸的烧杯中 将锌片插入盛有一定量稀硫酸的烧杯中 | |
| B. |  向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 | |
| C. |  向足量碳酸镁和氧化镁固体中分别加入相同质量、相同质量分数稀盐酸中 向足量碳酸镁和氧化镁固体中分别加入相同质量、相同质量分数稀盐酸中 | |
| D. |  向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量 向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量 |
| A. |  加热一定量的高锰酸钾固体 加热一定量的高锰酸钾固体 | B. |  两份完全相同的过氧化氢溶液分解 两份完全相同的过氧化氢溶液分解 | ||
| C. |  向一定量铁粉中加入硫酸铜溶液 向一定量铁粉中加入硫酸铜溶液 | D. |  加热一定量的饱和石灰水 加热一定量的饱和石灰水 |

 在物质的宏观性质、微观组成(或结构)和表示符号之间建立联系是化学学科的特点.某化学反应的微观示意图(表示氧原子,表示氢原子)如图:
在物质的宏观性质、微观组成(或结构)和表示符号之间建立联系是化学学科的特点.某化学反应的微观示意图(表示氧原子,表示氢原子)如图: