题目内容
11.一氧化碳不仅可作燃料,还能作化工原料.工业上用CO通过化合反应制备甲酸钠(化学式为CHO2Na),其主要流程如下:
(1)焦炭在高温条件下发生反应的基本类型是化合反应.
(2)第一次加入NaOH溶液的目的是吸收二氧化碳或者除去二氧化碳.
(3)合成甲酸钠的化学方程式是CO+NaOH$\frac{\underline{\;一定条件\;}}{\;}$CHO2Na.
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)焦炭在高温条件下发生的反应是碳和氧气反应生成二氧化碳或者一氧化碳,为两种物质生成一种物质,为多变一,为化合反应.
(2)由于过程中生成二氧化碳和一氧化碳,为避免二氧化碳和氢氧化钠反应而导致甲酸钠中含有碳酸钠,所以需要控制条件让二氧化碳先和氢氧化钠反应,这样得到只含氮气一种杂质的一氧化碳,进而和氢氧化钠继续反应,所以第一次加入NaOH溶液的目的是 吸收二氧化碳或者除去二氧化碳.
(3)由于提示“CO通过化合反应制备甲酸钠”,所以合成甲酸钠使用一氧化碳和氢氧化钠反应,且只生成甲酸钠,对应的化学方程式是 CO+NaOH$\frac{\underline{\;一定条件\;}}{\;}$CHO2Na.
故答案为:
(1)化合反应.
(2)吸收二氧化碳或者除去二氧化碳.
(3)CO+NaOH$\frac{\underline{\;一定条件\;}}{\;}$CHO2Na.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

练习册系列答案
相关题目
17.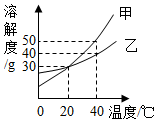 甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )
 甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | 40℃时,分别在100g水中加入40g甲、乙,充分溶解后,所得溶液中溶质的质量分数相等 | |
| C. | 20℃时,甲物质和乙物质的溶液中溶质的质量分数一定相等 | |
| D. | 分别将40℃的甲物质和乙物质的饱和溶液降温到20℃,甲析出晶体量一定大于乙 |
16.下列图象能正确反映对应变化关系的是( )
| A. |  加热一定质量的高锰酸钾固体 | |
| B. |  一定量的稀硫酸中滴加氢氧化钠溶液至过量 | |
| C. |  一定温度下,向饱和硝酸钾溶液中不断加入硝酸钾固体,充分搅拌 | |
| D. |  分别向同质量、同质量分数的稀盐酸中不断加入碳酸钙和氧化钙固体 |
1.我市某地盛产石灰石,其中含有不溶于盐酸的杂质.某化学兴趣小组为了测定石灰石中碳酸钙的含量,取8.0g石灰石样品,经粉碎后全部放入烧杯中,并加入足量的稀盐酸,反应前烧杯及所盛物质的总质量为80.0g.反应过程中测得烧杯及所盛物质的质量与相应时间记录如下表:
试计算:
(1)反应结束后,共放出2.2 克的二氧化碳;
(2)该石灰石样品中碳酸钙的质量分数是多少?
| 反应时间/分 | 0 | 2 | 4 | 6 | 8 | 10 |
| 烧杯及所盛物质质量/克 | 80.0 | 79.0 | 78.3 | 77.9 | 77.8 | 77.8 |
(1)反应结束后,共放出2.2 克的二氧化碳;
(2)该石灰石样品中碳酸钙的质量分数是多少?




 表示的微粒符号为H2O.
表示的微粒符号为H2O.