题目内容
12.保险粉(化学式为Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定,在NaCl存在下,Na2S2O4在水中溶解度显著下降.制备流程如图: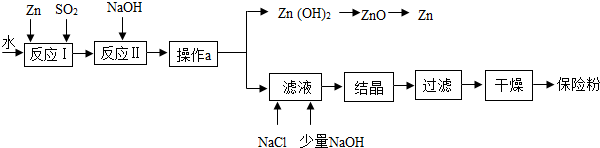
(1)操作a的名称为过滤,此操作中玻璃棒的作用是引流.
(2)反应Ⅱ为复分解反应,该反应的化学方程式为2NaOH+ZnS2O4=Zn(OH)2↓+Na2S2O4.
(3)滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是在NaCl存在下,Na2S2O4在水中溶解度显著下降.
(4)198gZn(OH)2理论上能得到Zn的质量为130g.
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)操作a是不溶性物质氢氧化锌和溶液分离的操作,为过滤,在过滤操作中玻璃棒的作用是引流.
(2)由于反应Ⅱ为复分解反应,且是氢氧化钠参加反应,生成物为Zn(OH)2和Na2S2O4,所以另一反应物为ZnS2O4,对应的化学方程式为2NaOH+ZnS2O4=Zn(OH)2↓+Na2S2O4.
(3)由于信息提示“Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定,在NaCl存在下,Na2S2O4在水中溶解度显著下降”,所以滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是在NaCl存在下,Na2S2O4在水中溶解度显著下降.
(4)198gZn(OH)2理论上能得到Zn的质量为198g×$\frac{65}{65+(16+1)×2}$×100%=130g.
故答案为:
(1)过滤;引流.
(2)2NaOH+ZnS2O4=Zn(OH)2↓+Na2S2O4.
(3)Na2S2O4在碱性溶液中稳定;在NaCl存在下,Na2S2O4在水中溶解度显著下降.
(4)130.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
2.从一瓶久置的氢氧化钠固体中取出22.6g于烧杯中,向其中加入足量的水,充分溶解后,加入适量氢氧化钡溶液使其恰好完全反应,过滤,将滤液蒸干得固体20g,则该瓶固体中变质的氢氧化钠占原氢氧化钠固体的质量分数为( )
| A. | 40% | B. | 47% | C. | 53% | D. | 60% |
20.油脂的主要生理功能是贮存和供应热能,在代谢中可以提供的能量比糖类和蛋白质约高一倍.下列食物中富含油脂的是( )
| A. | 花生油 | B. | 辣椒 | C. | 马铃薯 | D. | 米饭 |
4.下列各组离子,在指定溶液中能大量共存的一组是( )
| A. | 在硝酸钠溶液中:K+、Ca2+、Cl- | B. | 在稀盐酸中:Ba2+、CO32-、Zn2+ | ||
| C. | 在硝酸铵溶液中:Na+、Cu2+、OH- | D. | 在氢氧化钠溶液中:H+、Mg2+、Cl- |
