题目内容
16.下列给出的仪器中:①试管 ②烧杯 ③烧瓶 ④蒸发皿⑤集气瓶 ⑥量筒 ⑦漏斗 ⑧试剂瓶 ⑨燃烧匙(1)不允许用酒精灯加热的是⑤⑥⑦⑧
(2)可用作给固体加热的是①④⑨
(3)可用作给液体加热的是①②③④
(4)加热时应垫上石棉网的是②③.
分析 实验室中能够加热的仪器有两种:直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;不能加热的仪器有:容量瓶、漏斗、量筒、集气瓶、广口瓶等,据此完成本题.
解答 解:⑤集气瓶 ⑥量筒⑦漏斗 ⑧试剂瓶这些仪器不用进行加热. ①试管 ④蒸发皿⑨燃烧匙都可以用作给固体加热. ①试管②烧杯③烧瓶④蒸发皿都可用作给液体加热 ②烧杯③烧瓶加热时底部需要垫上石棉网才能进行加热,否则造成受热不均匀而使底部破裂,
故答案:(1)⑤⑥⑦⑧(2)①④⑨(3)①②③④(4)②③
点评 本题考查了常见仪器的使用方法,题目难度不大,注意掌握常见仪器的构造及使用方法,试题培养了学生灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 将水通过活性炭净水器,以降低水的硬度 | |
| B. | 物质都由分子构成 | |
| C. | 元素的化学性质主要由最外层电子数决定 | |
| D. | 元素的种类由最外层电子数决定 |
7.下列哪种溶液不能用来比较锌与铜两种金属活动性的强弱( )
| A. | 硫酸亚铁 | B. | 盐酸 | C. | 氢氧化钠 | D. | 硫酸铜 |
4.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】(1)该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】(2)针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(3)①丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】②中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:①实验操作中的错误是将pH试纸直接放入待测液测pH.②实验方案中也有一个是错误的,错误的原因是生成的Na2SO4也会与BaCl2反应产生白色沉淀,不一定是有过量H2SO4引起的.
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在如图1反应后的方框中补画未画全的微粒.
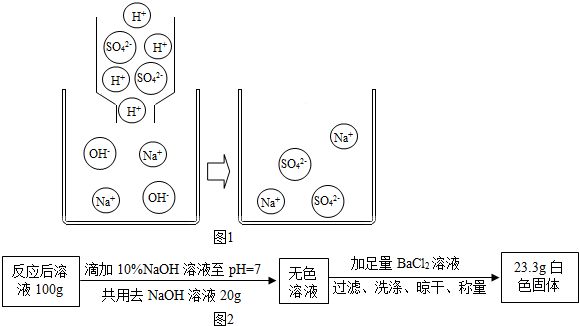
【定量探究】
取上述【演示实验】反应后烧杯中的溶液100g,设计如图2实验:
试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】(1)该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】(2)针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(3)①丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
| 实验操作 |  | 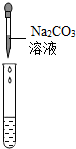 | 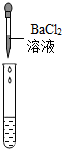 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有产生气泡 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】②中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:①实验操作中的错误是将pH试纸直接放入待测液测pH.②实验方案中也有一个是错误的,错误的原因是生成的Na2SO4也会与BaCl2反应产生白色沉淀,不一定是有过量H2SO4引起的.
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在如图1反应后的方框中补画未画全的微粒.

【定量探究】
取上述【演示实验】反应后烧杯中的溶液100g,设计如图2实验:
试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)
1.某实验中,老师请同学们用试管取一些稀盐酸,下列四位同学的操作合理的是( )
| A. | 向试管内滴入2滴稀盐酸 | B. | 向试管内注入 3 mL稀盐酸 | ||
| C. | 向试管内注入 1.5 mL稀盐酸 | D. | 向试管内倒入大半试管稀盐酸 |
5.平静呼吸时,一般成年人每次吸入和呼出的气体量相等,约为500ml.平静呼气之末肺内尚存有气体约2400ml.气体成分测定和分析表明:吸入气、呼出气和肺泡气中各种气体成分的百分比大致如表所示:
(1)判断:X是氮气,Y是氧气.
(2)回答:因参与人体新陈代谢而消耗的气体是氧气.
(3)分析:X气体在呼吸过程中没有参与化学反应,但在呼出气体中体积分数却减少了,原因是氮气的含量比例减少主要是由于CO2和水蒸气等气体的含量增加引起的.
(4)试设计实验或列举生活中的事实证明我们呼出的气体中含有二氧化碳和水蒸气.
| 气体成分% | X | Y | 二氧化碳 | 水蒸气 | 其它 |
| 吸入气体% | 78 | 21 | 0.03 | 0.01 | 0.96 |
| 呼出气体% | 75 | 15 | 3.68 | 5.44 | 0.88 |
(2)回答:因参与人体新陈代谢而消耗的气体是氧气.
(3)分析:X气体在呼吸过程中没有参与化学反应,但在呼出气体中体积分数却减少了,原因是氮气的含量比例减少主要是由于CO2和水蒸气等气体的含量增加引起的.
(4)试设计实验或列举生活中的事实证明我们呼出的气体中含有二氧化碳和水蒸气.
| 实验步骤 | 实验现象 | 结论 |
| 呼出的气体中含有二氧化碳 | ||
| 呼出的气体中含有水蒸汽 |
6.下列叙述不正确的是( )
| A. | 黄铜和铜相比,强度和硬度都要高一些 | |
| B. | 一般在水龙头表面镀铬以防生锈 | |
| C. | 银的导电性比铜好,应该提倡使用银制导线 | |
| D. | 钛合金与人体具有很好的相容性,可用来制造人造骨 |