题目内容
炼钢厂用含SO2的废气制取CuSO4.生产中,向混有CuO粉末的CuSO4溶液中通入废气,反应为:2CuO+2SO2+O2=2CuSO4.欲制得溶质的质量分数为20%的CuSO4溶液,用足量CuO粉末和5000g 5%的CuSO4溶液处理废气.
(1)SO2的相对分子质量是 ,其中硫、氧两种元素的质量比为 .
(2)若每升废气中含有1.25g SO2,且SO2被完全吸收,上述混有CuO粉末的5000g 5% CuSO4溶液可处理废气多少升?(相对原子质量:H-1,C-12,O-16,S-32,Cu-64 )
(1)SO2的相对分子质量是
(2)若每升废气中含有1.25g SO2,且SO2被完全吸收,上述混有CuO粉末的5000g 5% CuSO4溶液可处理废气多少升?(相对原子质量:H-1,C-12,O-16,S-32,Cu-64 )
考点:相对分子质量的概念及其计算,元素质量比的计算,根据化学反应方程式的计算
专题:化学式的计算,有关化学方程式的计算
分析:根据已有的知识进行分析,相对分子质量就是化学式中各元素相对原子质量的总和;元素的质量比就是相对原子质量与原子个数乘积的比值;根据反应的化学方程式,找出已知物质和待求物质,进行解答即可.
解答:解:(1)SO2的相对分子质量是32+16×2=64,其中硫、氧两种元素的质量比为:32:16×2=1:1;
(2)5000g 5% CuSO4溶液中含有氧化铜的质量为:5000g×5%=250g,设处理二氧化硫的质量为x
2CuO+2SO2+O2=2CuSO4.
160 124
250g x
=
x=193.75g
每升废气中含有1.25g SO2,则废气的体积是:
=155L
答:能处理废气155L.
(2)5000g 5% CuSO4溶液中含有氧化铜的质量为:5000g×5%=250g,设处理二氧化硫的质量为x
2CuO+2SO2+O2=2CuSO4.
160 124
250g x
| 160 |
| 250g |
| 124 |
| x |
每升废气中含有1.25g SO2,则废气的体积是:
| 193.75g |
| 1.25g/L |
答:能处理废气155L.
点评:本题考查了根据化学式以及根据化学方程式的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
从金银花中提取的绿原酸(其化学式为C16H18O9)有很高的药用价值.下列有关绿原酸的说法正确的是( )
| A、绿原酸属于混合物 |
| B、绿原酸由碳、氢、氧三种元素组成 |
| C、绿原酸的相对分子质量为354 g |
| D、绿原酸中碳、氢元素的质量比为16:18 |
下列物质中,属于氧化物的是( )
| A、O2 |
| B、H2O |
| C、NaOH |
| D、KMnO4 |
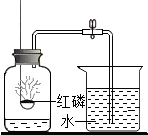 红磷燃烧除需要氧气外,还需要满足的条件是什么?
红磷燃烧除需要氧气外,还需要满足的条件是什么?

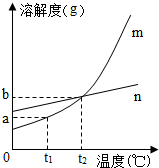 甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.
甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.