题目内容
7.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350℃左右开始分解放出氧气.过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面.其工业制备的主要流程如图1: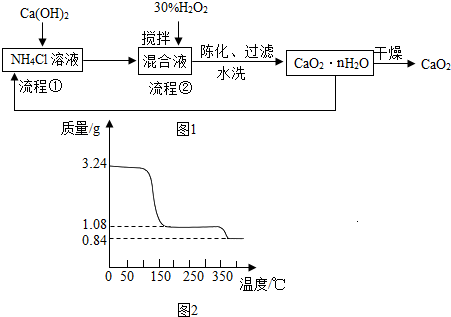
(1)搅拌的目的是充分反应.
流程②中没有采用加热措施的可能原因是防止过氧化氢分解(或防止氨气逸出);
流程②的化学反应方程式为CaCl2+H2O2+2NH3+nH2O=CaO2•nH2O↓+2NH4Cl.
(2)整个流程中,除水外还可以循环使用的物质是氯化铵.
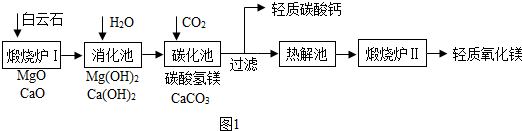
(3)取上述制得的CaO•nH2O晶体进行热重分析,其热分解时晶体的质量分数随温度变化的曲线如图2.请写出详细计算过程,得出过氧化钙晶体的化学式.
分析 (1)根据化学反应中进行搅拌的目的以及防止物质分解或逸出来分析;根据化学反应原理以及化学方程式的写法来分析;
(2)根据工艺流程图来分析解答;
解答 解:(1)在化学反应中,进行搅拌的目的是使化学反应进行的充分;流程②中,若加热会造成过氧化氢分解、氨气逸出;故填:充分反应;防止过氧化氢分解(或防止氨气逸出);
反应物是氯化钙、过氧化氢、氨气和水,生成物是氯化铵和CaO2•nH2O;故填:CaCl2+H2O2+2NH3+nH2O=CaO2•nH2O↓+2NH4Cl;
(2)由工艺流程图以及发生的化学反应可知,生成物中的氯化铵可以循环使用;故填:氯化铵;
(3)解:从图中看出:过氧化钙的质量是1.08g,则结晶水的质量=3.24g-1.08g=2.16g;由化学式CaO2•nH2O可知,其中CaO2和结晶水的质量比为:
72:18n=1.08g:2.16g
n=8
则化学式为:CaO2•8H2O.
点评 本题考查化实验制备化工流程、反应原理、有关图象的计算等有关问题,是对学生综合能力的考查,难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
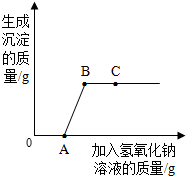 将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图曲线,根据图示回答问题:
将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图曲线,根据图示回答问题:
