题目内容
6.已知化学反应Al2O3+2NaOH=2R+H2O,推断R的化学式是( )| A. | Na2O | B. | Al(OH)3 | C. | NaAlO2 | D. | NaAlO |
分析 根据化学变化前后原子的种类、数目不变,由反应的化学方程式Al2O3+2NaOH=2R+H2O,推断反应中反应物R的分子构成,根据分子的构成确定R物质的化学式.
解答 解:由反应的化学方程式Al2O3+2NaOH=2R+H2O,可判断反应前后C、H、O、Na四种原子的个数为
反应前 反应后
Al原子 2 0
H原子 2 2
O原子 5 1
Na原子 2 0
根据化学变化前后原子的种类、数目不变,可判断物质R的2个分子中含2个Al原子,4个O原子,2个Na原子,则每个R的分子由1个Al,2个O原子构成,1个Na原子构成,则物质R的化学式为NaAlO2;
故选:C
点评 根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.

练习册系列答案
相关题目
16.以下说法不正确的是( )
| A. | 熟石灰可用来做建筑材料以及中和酸性土壤 | |
| B. | 用水灭火的原理是降低了可燃物的着火点 | |
| C. | 用C、H2、CO都可以将CuO还原成Cu | |
| D. | 燃烧和缓慢氧化都是放热反应 |
14.下列实验操作不能达到实验目的是( )
| 选项 | 实验目的 | 主要操作 |
| A | 用自来水制取蒸馏水 | 加热沸腾,水蒸气冷凝 |
| B | 区别化纤与羊毛面料 | 分别取样点燃,闻气味 |
| C | 除去氨气中混有的水蒸气 | 气体通入盛有浓硫酸的洗气瓶中 |
| D | 探究酒精中是否含有碳元素 | 将燃烧产物通入澄清石灰水中 |
| A. | A | B. | B | C. | C | D. | D |
11. 为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验.
为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验.
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光.
【实验二】取粗细、长短相同的锌丝、铜丝、镍丝均与50mL稀盐酸反应,实验记录如下:
【实验三】金属锌、铜和稀盐酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光.
(1)实验一的现象说明三种金属都具有导电性.
(2)镍与稀盐酸反应生成氯化镍(NiCl2)和氢气,反应的化学方程式是Ni+2HCl═NiCl2+H2↑,铜不能与稀盐酸发生化学反应的原因是铜不活泼,在金属活动性顺序中排在氢的后面.
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的锌丝、镍丝放入15%的50mL稀盐酸中,观察放出气泡的快慢.
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变.下列关于实验三分析正确的是C(填选项).
A.铜的金属活动性变得比锌强 B.铜与稀盐酸发生了置换反应 C.该装置将化学能转化为电能.
 为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验.
为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验.【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光.
【实验二】取粗细、长短相同的锌丝、铜丝、镍丝均与50mL稀盐酸反应,实验记录如下:
| 锌 | 铜 | 镍 | 铜 | |
| 稀盐酸的质量分数 | 3% | 3% | 15% | 15% |
| 反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
(1)实验一的现象说明三种金属都具有导电性.
(2)镍与稀盐酸反应生成氯化镍(NiCl2)和氢气,反应的化学方程式是Ni+2HCl═NiCl2+H2↑,铜不能与稀盐酸发生化学反应的原因是铜不活泼,在金属活动性顺序中排在氢的后面.
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的锌丝、镍丝放入15%的50mL稀盐酸中,观察放出气泡的快慢.
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变.下列关于实验三分析正确的是C(填选项).
A.铜的金属活动性变得比锌强 B.铜与稀盐酸发生了置换反应 C.该装置将化学能转化为电能.
11. a、b、c三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是( )
a、b、c三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是( )
 a、b、c三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是( )
a、b、c三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是( )| A. | t1℃时将20g a物质放入50g水中,充分搅拌后得到70g a溶液 | |
| B. | t2℃时配制等质量的三种物质的饱和溶液,c所需要的水最少 | |
| C. | 在t2℃下,将c物质的不饱和溶液变为饱和溶液,溶液的质量可能变大 | |
| D. | t3℃时,分别将三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为b>a=c |

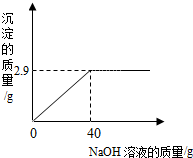 某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓ 地球上水的分布是:海洋咸水97%,淡水3%,而淡水的分布又如图所示,回答:
地球上水的分布是:海洋咸水97%,淡水3%,而淡水的分布又如图所示,回答: