题目内容
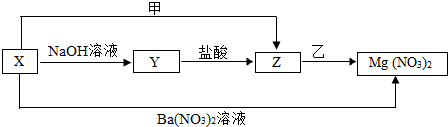
8.某实验小组在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和酸碱指示剂进行实验的过程如图,回答下列相关问题.
(1)所加试剂①是NaOH溶液;
(2)为了安全处理废液,要先验证最后得到的无色溶液中溶质的成分,下列所选药品能达到实验目的是ABD.
A.Fe2O3
B.Zn
C.AgNO3溶液
D.NaOH溶液.
分析 (1)根据碱能使无色酚酞变红,酸碱能发生中和反应,观察图示情况解答即可;
(2)根据溶液的酸性、中性检验方法来分析.
解答 (1)由第二步烧杯中液体变为红色可知,①中试剂为碱NaOH溶液,②中为酚酞;加上试剂③后溶液变为无色,证明了碱被消化掉,故可判断③是稀盐酸,酸与碱发生了中和反应;故填:NaOH溶液;
(2)反应后的溶液显中性(NaCl)或酸性(NaCl、HCl),那么可以加入氧化铁,若氧化铁溶解,溶液变成黄色,则酸性,否则为中性;
可以加入锌,若有气泡产生,则为酸性,否则为中性;
可以加入氢氧化钠溶液,若变红色,则为中性,否则为酸性.
故填:ABD.
点评 本题以图象的形式考查了酸碱中和反应时溶液PH的变化,以及物质间的质量关系、气体的收集、气密性的检查,知识点较多,解答中和反应的问题时要掌握溶液的酸碱性和溶液PH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
16.维生素A又称视黄醇对治疗夜盲症有重要作用,化学式可表示为化学式可表示为C20H30OX,相对分子质量为286.下列有关视黄醇的说法中正确的是( )
| A. | 视黄醇属于氧化物 | |
| B. | 视黄醇的化学式中X=2 | |
| C. | 视黄醇中碳元素的质量分数约为39.2% | |
| D. | 视黄醇中碳元素与氢元素的质量比为8:1 |
13. 树状分类法是日常生活和科学研究中常用的一种方法.如图所示的是一种树状分类的运用实例.下表所列的分类与如图分类不相符的是( )
树状分类法是日常生活和科学研究中常用的一种方法.如图所示的是一种树状分类的运用实例.下表所列的分类与如图分类不相符的是( )
 树状分类法是日常生活和科学研究中常用的一种方法.如图所示的是一种树状分类的运用实例.下表所列的分类与如图分类不相符的是( )
树状分类法是日常生活和科学研究中常用的一种方法.如图所示的是一种树状分类的运用实例.下表所列的分类与如图分类不相符的是( )| 选项 | 甲 | 乙 | 丙 | 丁 | … |
| A | 常见氮肥 | 尿素 | 碳铵 | 氨水 | … |
| B | 棕色试剂瓶装药品 | 硝酸 | 高锰酸钾 | 硝酸银 | … |
| C | 氧化物 | 水 | 氧化镁 | 干冰 | … |
| D | 常见空气污染物 | 二氧化硫 | 二氧化氮 | 二氧化碳 | … |
| A. | A | B. | B | C. | C | D. | D |
20.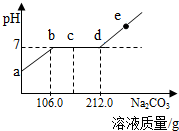 现向100.0g实验室制取CO2后的酸性废水中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法正确的是( )
现向100.0g实验室制取CO2后的酸性废水中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法正确的是( )
 现向100.0g实验室制取CO2后的酸性废水中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法正确的是( )
现向100.0g实验室制取CO2后的酸性废水中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法正确的是( )| A. | ab段产生白色沉淀 | |
| B. | c点对应的溶液中的溶质有2种 | |
| C. | d点对应溶液中溶质的质量为11.7g | |
| D. | 向e点溶液中滴加酚酞试液,溶液显红色 |
17.下列有关叙述正确的是( )
| A. | 常温下金属都是固体 | |
| B. | Ca(ClO)2其中氯元素的化合价是+3价 | |
| C. | 塑料凳子属于有机合成材料 | |
| D. | 发现煤气泄漏时,应立即打开排气扇电源开关排气 |
18.只用石蕊试液就能将下列各组溶液区分开来的是( )
| A. | NaCl NaOH NaNO3 | B. | NaOH H2SO4 KNO3 | ||
| C. | HCl NaCl Na2SO4 | D. | Na2SO4 H2SO4 KCl |
 A-H是初中化学常见的物质,其相互转化关系如图所示,其中A是人体胃液中帮助消化的物质,B用于改良酸性土壤.
A-H是初中化学常见的物质,其相互转化关系如图所示,其中A是人体胃液中帮助消化的物质,B用于改良酸性土壤. 在金属活动性顺序中,活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来.张老师在做钠与硫酸铜溶液反应的演示实验时,观察到的现象是:钠块在液面上很快融成一个银白色小球,并四处游动,溶液中出现蓝色絮状沉淀,小球很快停在絮状沉淀集中处燃烧起来,并伴随有轻微的爆炸声,却始终没有发现在钠表面有红色固体析出.对此,同学们展开了如下探究:
在金属活动性顺序中,活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来.张老师在做钠与硫酸铜溶液反应的演示实验时,观察到的现象是:钠块在液面上很快融成一个银白色小球,并四处游动,溶液中出现蓝色絮状沉淀,小球很快停在絮状沉淀集中处燃烧起来,并伴随有轻微的爆炸声,却始终没有发现在钠表面有红色固体析出.对此,同学们展开了如下探究: