题目内容
6.如表中除去物质中所含少量杂质的方法正确的是( )| 选项 | 物质 | 所含杂质 | 除杂质的方法 |
| A | 生石灰 | 石灰石 | 高温加强热 |
| B | 硫酸钠溶液 | 硫酸 | 加过量的碳酸钠溶液 |
| C | 铁 | 硫酸铜 | 加适量的水溶解、过滤、洗涤、干燥 |
| D | 二氧化碳 | 一氧化碳 | 将气体先通过足量的氢氧化钠溶液,再通过足量的浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、石灰石高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
B、硫酸能与过量的碳酸钠溶液反应生成硫酸钠、水和二氧化碳,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则,故选项所采取的方法错误.
C、加适量的水溶解后,铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
D、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
故选:A.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
16.下列相关比较中,关系正确的是( )
| A. | 金属活动性:铁<镁 | B. | 相同条件下密度:氢气>氧气 | ||
| C. | 导电能力:氢氧化钠溶液<蔗糖溶液 | D. | 着火点:纸片>煤炭 |
17.有一混合气体,经测定只含有甲烷和一氧化碳,现将3.0g该混合气体在氧气中充分燃烧,并将生成物先后依次通过足量的浓硫酸和碱石灰,确保生成物被充分吸收,测得浓硫酸增重3.6g.则下列有关说法中不正确的是( )
| A. | 混合气体中一氧化碳质量为1.4g | |
| B. | 碱石灰增重质量为6.6g | |
| C. | 混合气体中碳、氢元素的质量比为9:2 | |
| D. | 混合气体中两种气体分子数之比为3:1 |
11.有关水的说法正确的是( )
| A. | 海水、河水是混合物,自来水是纯净物 | |
| B. | 天然淡水经沉降、过滤、吸附、消毒等操作后,可供人们生活用水 | |
| C. | 电解水实验生成氢气和氧气,证明水是由氢气和氧气组成的 | |
| D. | 水和双氧水分子中都含有氢气分子 |
18.某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种
药品,探究哪两种药品的反应适合在实验室制取CO2.请你参与探究并回答问题.
【提出问题】上述酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是浓盐酸有挥发性.
讨论后大家设计了如图1三个实验进行对比分析.
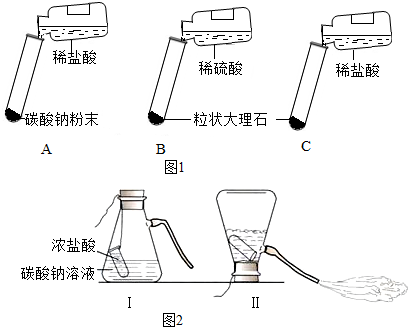
【实验与结论】
(1)请你填写实验报告中①、②处的内容.
(2)根据探究结论,实验室制取二氧化碳所发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
【拓展与迁移】
(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等.请你再写出一种需要考虑的因素:操作简便.
(2)实验室制取二氧化碳,为了控制反应速率,可以采用哪种方式向反应容器中加入酸?用分液漏斗将酸滴加到反应容器中.
(3)图2是一种灭火器的工作原理示意图,其中用碳酸钠和浓盐酸反应来产生CO2的理由是反应剧烈,产生大量气泡,导致容器内部气压迅速增大.
药品,探究哪两种药品的反应适合在实验室制取CO2.请你参与探究并回答问题.
【提出问题】上述酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是浓盐酸有挥发性.
讨论后大家设计了如图1三个实验进行对比分析.

【实验与结论】
(1)请你填写实验报告中①、②处的内容.
| 实验 | 实验现象 | 实验结论 |
| A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
| B | 产生气泡,速率迅速减慢,反应几乎停止. | 无法持续产生CO2,不能用于实验室制取CO2 |
| C | ①反应较强烈,产生大量气泡 | ②适宜制取二氧化碳 |
【拓展与迁移】
(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等.请你再写出一种需要考虑的因素:操作简便.
(2)实验室制取二氧化碳,为了控制反应速率,可以采用哪种方式向反应容器中加入酸?用分液漏斗将酸滴加到反应容器中.
(3)图2是一种灭火器的工作原理示意图,其中用碳酸钠和浓盐酸反应来产生CO2的理由是反应剧烈,产生大量气泡,导致容器内部气压迅速增大.
15.“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用.用足量的NaOH溶液来“捕捉”CO2,其过程的示意图如图所示(部分条件及物质未标出).下列有关该过程的叙述正确的是( )


| A. | 该过程可实现CO2零排放 | |
| B. | 整个过程中,有2种物质可以循环利用 | |
| C. | 整个过程中,涉及到两种碱 | |
| D. | “反应并分离”的过程中,分离物质的操作是蒸发、结晶 |