题目内容
1.在强酸性溶液中,下列各组离子可能大量共存的是( )| A. | Cu2+、NH4+、SO42-、Cl- | B. | Na+、K+、CO32-、Cl- | ||
| C. | K+、Fe2+、MnO4-、Cl- | D. | Na+、K+、F-、Cl- |
分析 利用复分解反应的条件来判断物质能否共存的问题,若物质在水中离子重新结合生成水或气体或沉淀时,物质就不能共存;本题还要注意题干明确指出了是酸性溶液中,即说明该溶液中含有氢离子,所以,能与酸反应(即能与H+结合成气体或水等)的物质也是不能共存的.
解答 解:A、四种离子在酸性条件下不发生任何反应,能大量共存,故A正确;
B、H+与CO32-反应生成二氧化碳气体和水,不能大量共存,H+和OH-反应会生成水,所以不能大量共存,故B错误;
C、Fe2+、MnO4-、H+发生氧化还原反应,不能共存,故C错误;
D、四种离子在酸性条件下不发生任何反应,能大量共存,故D正确;
故选AD
点评 本题考查了物质能否共存的问题,完成此类题目,可以依据复分解反应的条件进行.在判断能否共存的同时还要注意习题的要求,本题的易错点就是容易忽视题干中溶液为酸性溶液这一条件.

练习册系列答案
相关题目
11.下列说法不正确的是( )
| A. | 用肥皂水可以区分软水和硬水 | B. | 工业废水不能直接排放 | ||
| C. | 淡水资源是取之不尽用之不竭的 | D. | 过量使用农药化肥会造成水体污染 |
6.实验室有一试管溶液,其残缺的标志中只剩下“Na”字样,已知它是无色液体,是初中化学中常用的试剂.小宏同学为探究其成分进行了猜想,并设计实验进行验证,有关内容见如表:
请你参与这一探究活动,根据上表回答下列问题:
(1)小宏的猜想二是:可能是氯化钠溶液.如果猜想成立,则产生沉淀的化学反应方程式为NaCl+AgNO3=AgCl↓+NaNO3.
(2)小宏的猜想三是:可能是硫酸钠溶液.如果猜想成立,则产生沉淀的化学反应方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl.
(3)小宏同学对猜想一所描述的实验现象和作出的结论是否正确?请判断并说明理由.不正确;使酚酞试液变红的不一定是氢氧化钠,可能是碳酸钠等;
(4)除了小宏的三种猜想,请你再补充一种猜想,模仿上述过程,设计简单的实验方案并验证你的猜想,将有关内容填入下表.
| 猜想 | 设计的实验步骤 | 可能的现象与结论 |
| 猜想一:可能是氢氧化钠溶液 | 用试管取少量样品,向其中滴入两滴酚酞试液. | 若酚酞试液变为红色,则猜想成立. 若酚酞试液无明显变化,则猜想不成立. |
猜想二:? | 用试管取少量样品,向其中先滴入适量的用硝酸酸化的硝酸钡溶液,然后滴入硝酸银溶液. | 若溶液先没有明显变化,后出现白色沉淀,则猜想成立.若与上述现象不同,则猜想不成立. |
猜想三:? | 用试管取少量样品,向其中先加入适量的盐酸溶液,然后滴入氧化镁溶液 | 若溶液先没有明显变化,后出现白色沉淀,则猜想成立.若与上述现象不同,则猜想不成立. |
(1)小宏的猜想二是:可能是氯化钠溶液.如果猜想成立,则产生沉淀的化学反应方程式为NaCl+AgNO3=AgCl↓+NaNO3.
(2)小宏的猜想三是:可能是硫酸钠溶液.如果猜想成立,则产生沉淀的化学反应方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl.
(3)小宏同学对猜想一所描述的实验现象和作出的结论是否正确?请判断并说明理由.不正确;使酚酞试液变红的不一定是氢氧化钠,可能是碳酸钠等;
(4)除了小宏的三种猜想,请你再补充一种猜想,模仿上述过程,设计简单的实验方案并验证你的猜想,将有关内容填入下表.
| 你补充的猜想 | 设计的实验步骤 | 可能的现象与结论 |
20. 化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.
化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
将二氧化碳通入盛有氢氧化钠溶液的大试管(如图).取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到有气泡产生,证明二氧化碳与氢氧化钠发生了反应;
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】小明认为溶质是Na2CO3;小刚认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】
小刚为了验证自己的猜想,进行了如下实验,请你补充完整.
【实验反思】写出二氧化碳与氢氧化钠反应的化学方程式CO2+2NaOH=Na2CO3+H2O.
【实验拓展】同学们联想到氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否发生,由同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴加边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7时”才可证明发生反应了,其原因是pH小于或等于7时,表明OH-被消耗,说明酸碱发生了反应.
【总结提高】试设计两种不同方案证明氢氧化钠和稀硫酸确实发生了反应,从实验操作、实验现象和实验结论等方面加以说明.
 化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.
化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.探究一:二氧化碳是否与氢氧化钠发生了化学反应?
将二氧化碳通入盛有氢氧化钠溶液的大试管(如图).取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到有气泡产生,证明二氧化碳与氢氧化钠发生了反应;
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】小明认为溶质是Na2CO3;小刚认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】
小刚为了验证自己的猜想,进行了如下实验,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量试管中的溶液于试管中,加入足量CaCl2溶液,过滤;②向滤液滴加适量酚酞试液. | 酚酞试液变红 | 小刚猜想成立 |
【实验拓展】同学们联想到氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否发生,由同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴加边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7时”才可证明发生反应了,其原因是pH小于或等于7时,表明OH-被消耗,说明酸碱发生了反应.
【总结提高】试设计两种不同方案证明氢氧化钠和稀硫酸确实发生了反应,从实验操作、实验现象和实验结论等方面加以说明.
| 实验操作 | 实验现象 | 实验结论 | |
| 方案一 | 在氢氧化钠溶液中滴加1~2滴酚酞试液,再向其中滴加稀硫酸 | 酚酞试液由红色变为无色 | 氢氧化钠和稀硫酸发生了反应. |
| 方案二 | 在常温的氢氧化钠溶液中滴加同温稀硫酸用温度计测量混合液的温度 | 混合液温度明显升高 |


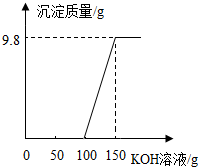 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答: 分析如图,请用化学用语回答问题:
分析如图,请用化学用语回答问题: