题目内容
16. 如图是浓盐酸试剂瓶上标签的部分内容.请回答:
如图是浓盐酸试剂瓶上标签的部分内容.请回答:(1)该浓盐酸的溶质是HCl(填化学式).
(2)现要配制3%的稀盐酸120g,需要这种浓盐酸10g.
(3)盐酸等许多酸都能使紫色石蕊溶液变红,是因为酸溶液中都含有相同的氢离子.
(4)使用一段时间后,浓盐酸的溶质质量分数小于36%,原因是浓盐酸具有挥发性.
(5)常用盐酸除去铁锈,反应的化学方程式是Fe2O3+6HCl═2FeCl3+3H2O.
分析 (1)浓盐酸的溶质是氯化氢气体,溶剂是水,据此进行分析解答.
(2)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.
(3)根据酸具有相似化学性质的原因进行分析解答.
(4)根据浓盐酸具有挥发性,进行分析解答.
(5)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,写出反应的化学方程式即可.
解答 解:(1)浓盐酸的溶质是氯化氢气体,溶剂是水,氯化氢气体的化学式为:HCl.
(2)溶液稀释前后,溶质的质量不变,设需要这种浓盐酸的质量为x,则120g×3%=x×36% x=10g.
(3)盐酸等许多酸都能使紫色石蕊溶液变红,是因为酸溶液中都含有相同的氢离子.
(4)浓盐酸具有挥发性,故使用一段时间后,浓盐酸的溶质质量分数小于36%.
(5)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
故答案为:(1)HCl;(2)10;(3)氢离子;(4)浓盐酸具有挥发性;(5)Fe2O3+6HCl═2FeCl3+3H2O.
点评 本题难度不大,掌握酸的化学性质、浓盐酸具有挥发性、化学方程式的书写方法是正确就本题的关键.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
4.已知某固体混合物中可能含有NH4Cl、Na2SO4、NH4NO3、CuO,所有发生的反应都恰好完全反应.根据实验过程和发生的现象填写以下空白:

(1)气体A溶液的pH>7.
(2)沉淀D的化学式为BaSO4.
(3)一定有的物质是CuO、Na2SO4.
(4)该固体混合物中,还不能确定存在的是NH4Cl或NH4NO3,(写化学式)要进一步推理该固体混合物的组成,可用溶液E再实验确定可能含有的物质:

(1)气体A溶液的pH>7.
(2)沉淀D的化学式为BaSO4.
(3)一定有的物质是CuO、Na2SO4.
(4)该固体混合物中,还不能确定存在的是NH4Cl或NH4NO3,(写化学式)要进一步推理该固体混合物的组成,可用溶液E再实验确定可能含有的物质:
| 实验操作 | 实验现象 | 实验结论 |
| 取未知成分溶液E少许,加入硝酸银溶液, | 出现白色沉淀 | NH4Cl(用化学式表示) |
8.善于梳理化学知识,能使你头脑更聪明.以下梳理的知识有错误的一组是( )
| A | 物质的性质与用途 | B | 化学用语与意义 |
| 氧气能支持燃烧-用于炼钢 熟石灰具有碱性-改良酸性土壤 小苏打能和酸反应-治疗胃酸过多 | 2H-表示2个氢原子 3H2O-表示3个水分子 NO3-表示1个硝酸根离子 | ||
| C | 元素与人体健康 | D | 生活中的化学 |
| 缺铁-易得贫血症 缺碘-易引发甲状腺疾病 缺钙-会导致骨质疏松或佝偻病 | 硬水软化-采用过滤操作 食品干燥剂-常用生石灰 区分羊毛线和棉线-灼烧闻气味 |
| A. | A | B. | B | C. | C | D. | D |
5.在学习碱的化学性质时,某小组同学进行了如图所示的实验.

Ⅰ.探究碱的化学性质
①实验甲,随着稀盐酸的不断滴入,观察到溶液由红色变为无色;
②实验乙滴加氢氧化钠溶液后,观察到的气球变鼓;
③实验丙观察到试管内有白色沉淀产生,发生反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
Ⅱ.探究废液成分
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【查阅资料】BaCl2溶液呈中性且Na2CO3+BaCl2═BaCO3↓+2NaCl
【讨论交流】
①废液中一定含有的物质:碳酸钙、指示剂、水和氯化钠;
②还含有能使废液呈碱性的物质,同学们有如下猜想:
猜想1:碳酸钠;猜想2:氢氧化钠;
猜想3:氢氧化钠和碳酸钠;猜想4:氢氧化钠和氢氧化钙.
【查阅资料】BaCl2溶液呈中性,Na2CO3+BaCl2=BaCO3↓+2NaCl
【实验设计】
同学们认为需要先验证猜想4是否成立,所需要的试剂是碳酸钠溶液.
若猜想4不成立,则需要进行后续实验,请你完成表格.
【进行实验】同学们进行实验,通过观察实验现象,得出了猜想2成立.
【反思拓展】分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否有剩余.

Ⅰ.探究碱的化学性质
①实验甲,随着稀盐酸的不断滴入,观察到溶液由红色变为无色;
②实验乙滴加氢氧化钠溶液后,观察到的气球变鼓;
③实验丙观察到试管内有白色沉淀产生,发生反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
Ⅱ.探究废液成分
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【查阅资料】BaCl2溶液呈中性且Na2CO3+BaCl2═BaCO3↓+2NaCl
【讨论交流】
①废液中一定含有的物质:碳酸钙、指示剂、水和氯化钠;
②还含有能使废液呈碱性的物质,同学们有如下猜想:
猜想1:碳酸钠;猜想2:氢氧化钠;
猜想3:氢氧化钠和碳酸钠;猜想4:氢氧化钠和氢氧化钙.
【查阅资料】BaCl2溶液呈中性,Na2CO3+BaCl2=BaCO3↓+2NaCl
【实验设计】
同学们认为需要先验证猜想4是否成立,所需要的试剂是碳酸钠溶液.
若猜想4不成立,则需要进行后续实验,请你完成表格.
| 实验操作 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钡溶液,静置 | 有白色沉淀,溶液无色 | 猜想1正确 |
| 若没有白色沉淀,溶液呈红色 | 猜想2正确 | |
| 有白色沉淀,溶液呈红色 | 猜想3正确 |
【反思拓展】分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否有剩余.
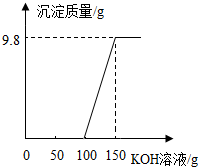 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答: 人类的生产生活都离不开水,水是最常见的液体.
人类的生产生活都离不开水,水是最常见的液体. 分析如图,请用化学用语回答问题:
分析如图,请用化学用语回答问题: