题目内容
11.下列物质在一定的温度下溶解恰好形成饱和溶液,其中溶解度最大的是( )| A. | 2g物质溶解在10g水里 | B. | 50g物质溶解在5000g水里 | ||
| C. | 2g物质溶解在200g水里 | D. | 0.5g物质溶解在50g水里 |
分析 根据已有的溶解度的概念进行分析解答即可.
解答 解:溶解度是指在一定温度下,某物质在100g水中最多溶解的质量;
A、2g物质溶解在10g水里,则100g水中最多溶解20g;
B、50g物质溶解在5000g水里,则100g水中最多溶解1g;
C、2g物质溶解在200g水里,则100g水中最多溶解1g;
D、0.5g物质溶解在50g水里,则100g水中最多溶解1g;
故A对应的物质溶解度最大,故选A.
点评 本题考查的是溶解度的概念的应用,完成此题,可以依据已有的知识进行.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
1.硝酸铵是一种氮肥,化学式NH4NO3,其铵根中的氮元素的化合价为( )
| A. | -3 | B. | +1 | C. | +4 | D. | +5 |
2.废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如图所示:
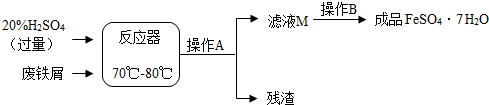
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还 有:Fe+H2SO4═FeSO4+H2↑;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(2)滤液M中肯定含有的溶质的化学式是FeSO4、H2SO4;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,操作B的名称是蒸发.
(4)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是B(填字母编号);
A.化合反应 B.置换反应C.分解反应D.复分解反应
(5)在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,分解产物有三氧化硫、二氧化硫和另一种氧化物,则该氧化物的化学式为Fe2O3.

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还 有:Fe+H2SO4═FeSO4+H2↑;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(2)滤液M中肯定含有的溶质的化学式是FeSO4、H2SO4;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | ||||||||
(4)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是B(填字母编号);
A.化合反应 B.置换反应C.分解反应D.复分解反应
(5)在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,分解产物有三氧化硫、二氧化硫和另一种氧化物,则该氧化物的化学式为Fe2O3.
16.下列化学方程式正确的是( )
| A. | 2Fe+6HCl═2FeCl3+3H2↑ | B. | Zn+2HNO3═Zn(NO3)2+H2↑ | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | Fe2O3+4HCl═2FeCl2+3H2O |
1.下列实验操作中,正确的是( )
| A. |  倾倒液体 | B. |  测溶液pH | C. |  过滤 | D. |  塞紧橡皮塞 |
