题目内容
7. 称取-定质量的氯酸钾和二氧化锰,混合后放入大试管中加热至质量不再变化为止.实验测得固体混合物质量随加热时间变化的相关数据如右图所示.为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入85.1g水,使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离(二氧化锰在水中难溶).
称取-定质量的氯酸钾和二氧化锰,混合后放入大试管中加热至质量不再变化为止.实验测得固体混合物质量随加热时间变化的相关数据如右图所示.为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入85.1g水,使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离(二氧化锰在水中难溶).请计算:
(1)生成氧气的质量9.6克.
(2)所得到的滤液中氯化钾的质量分数(结果精确到0.1%).
分析 氯酸钾在二氧化锰的催化作用下分解生成氯化钾和氧气,反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算生成的氯化钾的质量,进一步可以计算所得到的滤液中氯化钾的质量分数.
解答 解:(1)生成氧气的质量为:32.0g-22.4g=9.6g,
故填:9.6.
(2)设生成氯化钾的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
149 96
x 9.6g
$\frac{149}{x}$=$\frac{96}{9.6g}$,
x=14.9g,
所得到的滤液中氯化钾的质量分数为:$\frac{14.9g}{14.9g+85.1g}$×100%=14.9%,
答:所得到的滤液中氯化钾的质量分数是14.9%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
18.下列有关CO2和CO的知识归纳,错误的是( )
| A. | 组成:1个二氧化碳分子比1个一氧化碳分子多1个氧原子 | |
| B. | 性质:都是无色无味的气体;都能溶于水,都能燃烧 | |
| C. | 用途:CO2用于灭火,“干冰”可用于人工降雨等;CO可作燃料、冶炼金属等 | |
| D. | 危害:CO2会造成“温室效应”;CO极易与血液中的血红蛋白结合引起中毒 |
2.化学变化中,同种元素可以在不同物质中“旅行”,下列转化关系中不符合“甲?乙?丙”“旅行”路线的是( )
| 甲 | 乙 | 丙 | 旅行元素 | |
| A | Cu | Cu(NO3)2 | Cu(OH)2 | Cu |
| B | O2 | CO2 | H2CO3 | O |
| C | H2 | H2O | Ca(OH)2 | H |
| D | CaO | Ca(OH)2 | CaCO3 | Ca |
| A. | A | B. | B | C. | C | D. | D |
16.工业上利用太阳能进行海水晒盐.已知海水蒸发浓缩过程中析出盐的种类和质量如下表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
(1)海水从密度为1.21g•mL-1浓缩到1.22g•mL-1时发生的变化是C.
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是硫酸钙.实际晒盐生产中,海水的密度一般控制在1.21g•mL-1~1.26g•mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-;Br-.
(3)如图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是B.

| 海水密度/(g•mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是硫酸钙.实际晒盐生产中,海水的密度一般控制在1.21g•mL-1~1.26g•mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-;Br-.
(3)如图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是B.

17.把金属X放入CuSO4溶液中,X表面有红色固体析出;若放入FeSO4溶液中,无明显现象. 则X、Cu、Fe三种金属活动性由强到弱的顺序正确的是( )
| A. | Fe、X、Cu | B. | X、Fe、Cu | C. | Fe、Cu、X | D. | Cu、X、Fe |
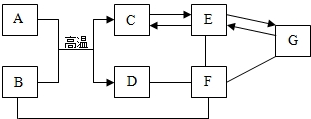 初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.
初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.