题目内容
11.工业上利用电石(CaC2)制备高纯碳酸钙的流程如下: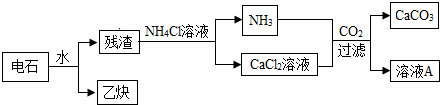
已知:①CaC2+2H2O═Ca(OH)2+C2H2↑ ②CaCl2+H2O+CO2+2NH3═CaCO3↓+2NH4Cl
(1)乙炔(C2H2)是一种常见的燃料,写出乙炔完全燃烧的化学方程式2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
(2)流程中可循环使用的物质是NH4Cl(填化学式).
(3)若将电石长期露置于空气中,会发生一系列变化,最终所得固体中一定含有的物质是CaCO3,用化学方程式表示存在该物质的原因CO2+Ca(OH)2=CaCO3↓+H2O.
(4)电石应该密封保存.
分析 (1)根据质量守恒定律写出反应物和生成物及方程式;
(2)根据流程判断反应前后质量没有发生变化的物质;
(3)根据信息分析反应的生成物及反应的方程式;
(4)根据信息分析电石的保存方法.
解答 解:(1)根据质量守恒定律化学反应前后元素的种类不变可知乙炔(C2H2)完全燃烧产生二氧化碳和水,故反应的方程式为:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O;
(2)由流程图可以看出,氯化铵和残渣反应产生氨气和氯化钙,氨气、二氧化碳和氯化钙和水反应生成碳酸钙和氯化铵,因此可以循环使用的物质是氯化铵,故填:NH4Cl;
(3)根据信息电石和水反应会产生氢氧化钙,氢氧化钙会继续吸收二氧化碳产生碳酸钙沉淀,因此电石长期露置于空气中,会发生一系列变化,最终所得固体中一定含有的物质是碳酸钙;故填:CaCO3;CO2+Ca(OH)2=CaCO3↓+H2O;
(4)因电石极易与水反应,故应密封保存;故填:密封.
点评 本题属于信息题的考查,综合考查了产物的判断、化学方程式的书写,锻炼了学生的逻辑思维和分析解决问题的能力.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
4.双乙酰(C4H6O2)主要用作奶油、人造奶油、干酪和糖果的增香剂、明胶的硬化剂等,下列关于双乙酰的说法中正确的是( )
| A. | 双乙酰属于有机高分子化合物 | |
| B. | 双乙酰中氧元素的质量分数最大 | |
| C. | 双乙酰分子由碳元素、氢元素、氧元素构成 | |
| D. | 双乙酰中碳元素与氢元素的质量比为8:1 |
20.某化工厂生产的纯碱产品(含有少量氯化钠),为了测定样品中纯碱的质量分数,将不同质量的纯碱产品分别放入4个盛有浓度相同、质量均为50g的稀盐酸的烧杯中,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
(1)烧杯1中产生二氧化碳的质量为1.1gg.
(2)样品与稀盐酸恰好完全反应时,所得溶液中溶质质量分数是多少?(精确到0.1%)
| 称量的产品质量/g | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
| 加入纯碱产品质量/g | 3.6 | 7.2 | 14.4 | 16.4 |
| 烧杯中剩余物的质量/g | 52.5 | 55 | 60 | 62 |
(2)样品与稀盐酸恰好完全反应时,所得溶液中溶质质量分数是多少?(精确到0.1%)
7.下列实验现象不正确的是( )
| A. | 打开浓盐酸的试剂瓶盖,瓶口会出现白雾 | |
| B. | 生锈的铁钉放入稀硫酸中,溶液由无色变为黄色 | |
| C. | 一氧化碳通过灼热氧化铁,固体由红色变为黑色 | |
| D. | 水通电后,正极产生的气体能燃烧发出淡蓝色火焰 |
3.下列有关物质用途的说法,正确的是( )
| A. | 用碳酸钠给食物调味 | B. | 用氯化钠洗涤餐具上的油污 | ||
| C. | 用稀盐酸清除铁锈 | D. | 用氢氧化钠改良酸性土壤 |
 化学兴趣小组的同学用右图装置进行以下三个实验.
化学兴趣小组的同学用右图装置进行以下三个实验. 服装的面料会影响人们穿着的舒适程度.
服装的面料会影响人们穿着的舒适程度.