题目内容
15.某学习小组对课本中“食盐常用于制作纯碱”的内容产生兴趣在老师的指导下,获悉:NaCl+NH3 +CO2 ═NaHCO3 ↓+NH4Cl
将经过过滤、洗涤得到的NaHCO3 微小晶体,在加热煅烧制得纯碱产品.
2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑
探究活动.测定制得产品中碳酸钠的纯度
【实验1】用气化发测定
甲组同学为了测定该产品中碳酸钠的纯度,进行了一下实验,取17.0g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150.0g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
| 时间/t | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
(2)该产品中碳酸钠的质量分数(结果精确到0.1%)93.5%.
【反思与评价】
(3)加热煅烧NaHCO3后,得到固体样品中的成分为碳酸钠.
【实验2】用沉淀法测定
资料摘要:碳酸钠与氯化镁在溶液中发生反应:Na2CO3+MgCl2═Mg(CO3)2↓+2NaCl.
乙组同学按如图所示的实验步骤进行实验:
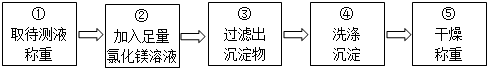
(4)步骤②加入的氯化镁溶液必需足量,其目的是使碳酸钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
分析 【实验1】(1)根据质量守恒定律进行分析;
(2)根据二氧化碳的质量结合化学方程式计算碳酸钠的质量,然后计算质量分数;
(3)根据碳酸氢钠受热会生成碳酸钠、水和二氧化碳进行分析;
【实验2】(4)根据为了使氢氧化钠溶液中的碳酸钠和氯化镁完全反应,氯化镁溶液应该是足量的进行分析.
解答 解:(1)根据质量守恒定律可知,生成二氧化碳的质量是:215.2g-208.6g=6.6g;
(2)设参加反应的碳酸钠的质量是x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 6.6g
$\frac{106}{x}$=$\frac{44}{6.6g}$
x=15.9g
所以该产品中碳酸钠的质量分数是93.5%;
(3)碳酸氢钠在受热的条件下生成碳酸钠、水和二氧化碳,所以加热煅烧NaHCO3后,得到固体样品中的成分为碳酸钠;
【实验2】(4)步骤②加入的氯化镁溶液必需足量,其目的是使碳酸钠完全反应;
滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化镁已经过量.
故答案为:(1)6.6g;
(2)93.5%;
(3)碳酸钠;
【实验2】(4)使碳酸钠完全反应;
滴取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化镁已经过量.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
5. 如图为常用气体洗气装置,X为所用试剂,下列不能达到实验目的是( )
如图为常用气体洗气装置,X为所用试剂,下列不能达到实验目的是( )
 如图为常用气体洗气装置,X为所用试剂,下列不能达到实验目的是( )
如图为常用气体洗气装置,X为所用试剂,下列不能达到实验目的是( ) | 选项 | 实验目的 | 选用试剂(X) |
| A | 将氢气干燥 | 浓H2SO4 |
| B | 除去二氧化碳中少量氯化氢 | NaHCO3溶液 |
| C | 除去氮气中少量二氧化硫 | NaOH溶液 |
| D | 除去氯化氢中少量的二氧化碳 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
6.下列过程中没有发生化学变化的是( )
| A. |  浓硫酸腐蚀布 | B. |  钟乳石的形成 | ||
| C. |  用钛合金制成人造骨 | D. |  塑料降解 |
3.下列属于复合材料的是( )
| A. | 玻璃 | B. | 玻璃钢 | C. | 有机玻璃 | D. | 钢化玻璃 |
20.下列做法符合科学道理的是( )
| A. | 用大量亚硝酸钠(Na2NO2)腌渍食品 | |
| B. | 用冷却结晶的方法从海水中提取粗盐 | |
| C. | 用含有氢氧化铝的药物治疗胃酸过多的病人 | |
| D. | 被黄蜂刺了(刺液呈碱性),涂上稀硫酸以减轻痛痒 |
7.为较准确测定海水中样品的酸碱度,你建议使用什么试剂或试纸( )
| A. | 烧碱溶液 | B. | 酚酞溶液 | C. | pH试纸 | D. | 石蕊溶液 |
16.下列各组物质中,前者属于混合物、后者属于纯净物的是( )
| A. | 海水、水 | B. | 医用酒精、自来水 | C. | 冰水混合物、氧气 | D. | 二氧化碳、铁 |
 铝在工业和日常生活中应用广泛.请回答:
铝在工业和日常生活中应用广泛.请回答: