题目内容
5. 如图为常用气体洗气装置,X为所用试剂,下列不能达到实验目的是( )
如图为常用气体洗气装置,X为所用试剂,下列不能达到实验目的是( ) | 选项 | 实验目的 | 选用试剂(X) |
| A | 将氢气干燥 | 浓H2SO4 |
| B | 除去二氧化碳中少量氯化氢 | NaHCO3溶液 |
| C | 除去氮气中少量二氧化硫 | NaOH溶液 |
| D | 除去氯化氢中少量的二氧化碳 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据浓硫酸有吸水性进行分析;
B、根据盐酸和碳酸氢钠反应生成二氧化碳进行分析;
C、根据二氧化硫会与氢氧化钠反应进行分析;
D、根据氯化氢、二氧化碳都会与氢氧化钙反应进行分析.
解答 解:A、浓硫酸有吸水性,将氢气通过浓硫酸可以将水除去,故A正确;
B、盐酸和碳酸氢钠反应生成二氧化碳,将混合气通过碳酸氢钠溶液,可以将氯化氢除去,剩下二氧化碳,故B正确;
C、二氧化硫会与氢氧化钠反应,氮气不会与氢氧化钠反应,可以将二氧化硫除去,故C正确;
D、氯化氢、二氧化碳都会与氢氧化钙反应,两种气体都会被除去,故D错误.
故选:D.
点评 利用所要鉴别物质的性质差别,设计实验使实验中出现明显的现象差异,达到鉴别物质的目的.

练习册系列答案
相关题目
15.如图是金刚石,石墨,C60,碳纳米管的结构示意图,下列说法正确的是( )


| A. | 四种物质都是只由碳元素组成,故是同一种碳单质 | |
| B. | 四种物质中碳纳米管是一种新型化合物 | |
| C. | 四种物质完全燃烧后的产物都是CO2 | |
| D. | 四种物质中金刚石与石墨的碳原子的结构不同 |
13.下列变化属于物理变化的是( )
| A. | 钢铁生锈 | B. | 水在通直流电情况下分解 | ||
| C. | 白磷自燃 | D. | 分离液态空气制取氧气 |
10.下列化学方程式符合变化事实的是( )
| A. | 用电解水的方法测定水的组成:2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+O2↑ | |
| B. | 用稀盐酸除去铁锈的反应:Fe2O3+6HCl═2FeCl3+3H2↑ | |
| C. | 赤铁矿炼铁:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 | |
| D. | 用二氧化碳制碳酸饮料:CO2+H2O═H2CO3 |
17.日常生活中人们常喝纯净水,而市场上出售的纯净水有一些是蒸馏水.对于这一类纯净水的下列说法中,正确的是( )
| A. | 它能够导电 | |
| B. | 它含有人体所需的矿物质和多种微量元素 | |
| C. | 它的pH=0 | |
| D. | 它清洁、纯净,但长期饮用对健康无益 |
14.下列叙述错误的是( )
| A. | 为了预防缺少微量元素碘引起的甲状腺肿大,可以食用加碘食盐 | |
| B. | 炉具清洁剂中含有氢氧化钠能与油脂发生反应,可以用于去除油污 | |
| C. | 可燃冰将成为未来新能源,目前可以代替其它化石能源进行大规模使用 | |
| D. | 家用天然气如果泄露,在通风不良的厨房里遇明火可能发生爆炸 |
15.某学习小组对课本中“食盐常用于制作纯碱”的内容产生兴趣在老师的指导下,获悉:
NaCl+NH3 +CO2 ═NaHCO3 ↓+NH4Cl
将经过过滤、洗涤得到的NaHCO3 微小晶体,在加热煅烧制得纯碱产品.
2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑
探究活动.测定制得产品中碳酸钠的纯度
【实验1】用气化发测定
甲组同学为了测定该产品中碳酸钠的纯度,进行了一下实验,取17.0g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150.0g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
(1)实验中产生的CO2气体质量为6.6g;
(2)该产品中碳酸钠的质量分数(结果精确到0.1%)93.5%.
【反思与评价】
(3)加热煅烧NaHCO3后,得到固体样品中的成分为碳酸钠.
【实验2】用沉淀法测定
资料摘要:碳酸钠与氯化镁在溶液中发生反应:Na2CO3+MgCl2═Mg(CO3)2↓+2NaCl.
乙组同学按如图所示的实验步骤进行实验:
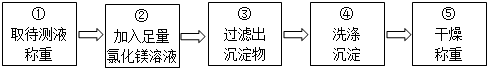
(4)步骤②加入的氯化镁溶液必需足量,其目的是使碳酸钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
NaCl+NH3 +CO2 ═NaHCO3 ↓+NH4Cl
将经过过滤、洗涤得到的NaHCO3 微小晶体,在加热煅烧制得纯碱产品.
2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2↑
探究活动.测定制得产品中碳酸钠的纯度
【实验1】用气化发测定
甲组同学为了测定该产品中碳酸钠的纯度,进行了一下实验,取17.0g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150.0g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
| 时间/t | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
(2)该产品中碳酸钠的质量分数(结果精确到0.1%)93.5%.
【反思与评价】
(3)加热煅烧NaHCO3后,得到固体样品中的成分为碳酸钠.
【实验2】用沉淀法测定
资料摘要:碳酸钠与氯化镁在溶液中发生反应:Na2CO3+MgCl2═Mg(CO3)2↓+2NaCl.
乙组同学按如图所示的实验步骤进行实验:

(4)步骤②加入的氯化镁溶液必需足量,其目的是使碳酸钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).

