题目内容
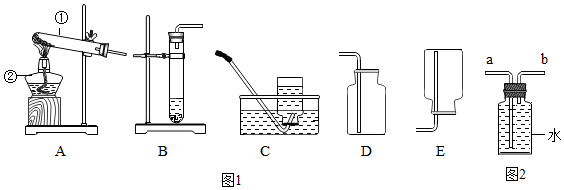
19.如图1为实验室常用的实验装置.回答问题:
(1)标号仪器的名称:①分液漏斗;②集气瓶.
(2)A、F组合制氧气,化学反应方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;当观察到装置F中气泡连续均匀冒出时才开始收集.
(3)用C、D组合制取CO2的优点是可以控制反应速度.
(4)写出用B装置制取二氧化碳的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑
(5)SO2通常是一种无色有刺激性气味的有毒气体,密度比空气大,易溶于水,排放到空气中会形成酸雨.实验室用如图2装置收集一瓶干燥的SO2,装置的导管按气流方向连接的顺序是c→d→b→a→e(填字母),装置中的X是浓硫酸,装置中的倒扣漏斗的作用是二氧化硫易溶于水,排放到空气中会形成酸雨,因此用水吸收.
分析 (1)熟练掌握常见的化学仪器及用途;
(2)用排水法收集氧气,要等到排出空气后再收集;收集后要防止水的倒流引起试管的炸裂;
(3)根据装置特点进行分析解答;
(4)根据实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳解答;
(5)二氧化硫的密度比空气大,因此应该从b进a出,干燥时应该c进d出,可以用浓硫酸干燥;二氧化硫易溶于水,排放到空气中会形成酸雨,因此用水吸收.
解答 解:
(1)①是分液漏斗,②是集气瓶;
(2)A是固固加热型,试管口有棉花,可以用高锰酸钾制氧气,学反应式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
用排水法收集的时机不能是刚一冒气泡,否则收集到的是空气使氧气不纯;
(3)用C、D组合制取CO2的优点是可以控制反应速度;
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,其化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)二氧化硫应该先干燥,再收集,最后多余的用水吸收,防止污染.二氧化硫的密度比空气大,因此应该从b进a出,干燥时应该c进d出,可以用浓硫酸干燥;二氧化硫易溶于水,排放到空气中会形成酸雨,因此用水吸收.
故答案为:
(1)①分液漏斗;②集气瓶;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.气泡连续均匀冒出;
(3)可以控制反应速度;
(4)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(5)c→d→b→a;浓硫酸;二氧化硫易溶于水,排放到空气中会形成酸雨,因此用水吸收.
点评 本题是一道有关气体制取拓展题,要求学生能够根据已有的知识经验进行运用,很好的考查了学生的分析实验能力、知识的运用能力.


 氢氧化钠与氢氧化钙是初中化学最常见的两种碱,根据你所学知识回答:
氢氧化钠与氢氧化钙是初中化学最常见的两种碱,根据你所学知识回答: