题目内容
17.为了测定某黄铜(铜锌合金)中锌的质量分数,某课外兴趣小组利用该合金与实验室中的一瓶稀硫酸反应,进行了若干次实验.现将其中的三次实验数据摘录如下:| 实验次数 | 1 | 2 | 3 |
| 稀硫酸的质量(g) | 100 | 100 | 100 |
| 加入黄铜的质量(g) | 6.5 | 13 | 19.5 |
| 充分反应后剩余物质的总质量(g) | 106.4 | 112.8 | 119.3 |
(1)第2次实验产生氢气的质量是0.2g.
(2)第2次实验,黄铜与稀硫酸恰好完全反应.
(3)计算黄铜中锌的质量分数(写出计算过程).
分析 (1)根据质量守恒定律解答;
(2)对比三次实验中稀硫酸质量、黄铜质量及生成氢气的质量三者间的关系,得出稀硫酸与黄铜恰好完全反应时的质量关系,判断所对应的实验;
(3)根据黄铜完全反应时放出氢气的质量,由反应的化学方程式,计算出黄铜中所含锌的质量,然后根据质量分数计算公式计算出黄铜中锌的质量分数.
解答 解:(1)第2次实验产生氢气的质量是:100g+13g-112.8g=0.2g;故填:0.2g;
(2)第1次实验产生氢气的质量是:100g+6.5g-106.4g=0.1g,
第3次实验产生氢气的质量是:100g+19.5g-119.3g=0.2g,
对比实验1、2,可知6.5g黄铜完全反应可得到0.1g氢气;对比实验2、3,可知100g稀硫酸完全反应可产生0.2g氢气;综合以上分析,可得第2所实验中100g稀硫酸与13g黄铜恰好完全反应产生0.2g氢气;故答案为:2;
(3)设13g黄铜中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}=\frac{2}{0.2g}$
x=6.5g
黄铜中锌的质量分数=$\frac{6.5g}{13g}×100%=50%$
答:黄铜中锌的质量分数为50%.
点评 对于此类实验数据处理类问题,可通过找出具有相同量的实验即相当于控制了该变量,分析其它量的变化,得出对反应进行情况的认识与判断.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
4.学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.用以下方法解决下列问题:
(1)分类法:利用下列4组物质
A.ZnO、MgO、CO2、Na2O B.Cu、N2、O2、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
请按要求填写下表空白(填写物质的化学式或分类标准)
(2)对比法:
A.通过对CO2+H2O═H2CO3;6CO2+6H2O$\frac{\underline{\;光照\;}}{\;}$C6H12O6+6O2两个化学反应的对比,你能得出的结论是相同的反应物在不同的反应条件下生成的产物可能不同.
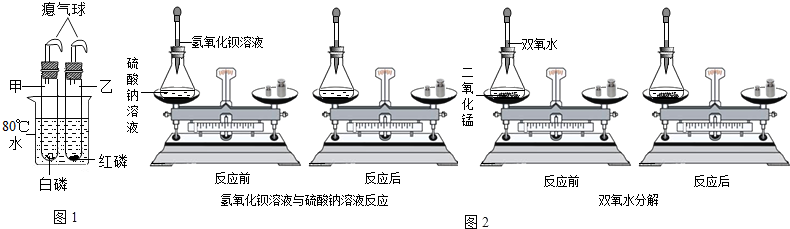
B.如图1所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一:可燃物温度达到着火点.
(3)归纳演绎法:
小海同学通过对大量化学反应如氢氧化钡溶液与硫酸钠溶液,双氧水分解(如图2)反应前后各物质的质量总和的测定,得出参加化学反应的各物质的质量总和等于(填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.根据小海得出的结论,可推出7.9g高锰酸钾加热一会后,剩余固体质量为7.5g,则反应生成氧气的质量为0.4g.
(1)分类法:利用下列4组物质
A.ZnO、MgO、CO2、Na2O B.Cu、N2、O2、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
请按要求填写下表空白(填写物质的化学式或分类标准)
| A | B | C | D | |
| 分类标准 | 金属氧化物 | ② | 盐 | ④ |
| 不属于该类别的物质 | ① | Cu | ③ | H2O |
A.通过对CO2+H2O═H2CO3;6CO2+6H2O$\frac{\underline{\;光照\;}}{\;}$C6H12O6+6O2两个化学反应的对比,你能得出的结论是相同的反应物在不同的反应条件下生成的产物可能不同.
B.如图1所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一:可燃物温度达到着火点.

(3)归纳演绎法:
小海同学通过对大量化学反应如氢氧化钡溶液与硫酸钠溶液,双氧水分解(如图2)反应前后各物质的质量总和的测定,得出参加化学反应的各物质的质量总和等于(填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.根据小海得出的结论,可推出7.9g高锰酸钾加热一会后,剩余固体质量为7.5g,则反应生成氧气的质量为0.4g.
5.如图所示的实验基本操作正确的是( )
| A. |  闻气味 | B. |  倾倒液体 | C. |  取固体药品 | D. |  加热液体 |
2.掌握正确的实验操作是做好实验的基础,下列实验操作正确的是( )
| A. |  实验室制取二氧化碳 | B. |  盖灭酒精灯 | ||
| C. |  实验室制取氧气 | D. |  过滤 |
9.下列变化中,都属于化学变化的一组是( )
| A. | 自行车胎爆炸、汽油燃烧 | B. | 菜刀生锈、铁水制成铁钉 | ||
| C. | 雪融化、酒精挥发 | D. | 呼吸作用、食物腐败 |
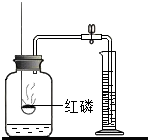 按如图测定空气中氧气的含量时,要达到实验目的,反应物或装置方面应满足的条件是红磷足量(或过量),装置气密性良好等;该实验还可说明氮气具有的性质是氮气不能燃烧,不能支持燃烧、氮气难溶于水等(至少两条).
按如图测定空气中氧气的含量时,要达到实验目的,反应物或装置方面应满足的条件是红磷足量(或过量),装置气密性良好等;该实验还可说明氮气具有的性质是氮气不能燃烧,不能支持燃烧、氮气难溶于水等(至少两条).