题目内容
3.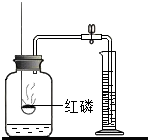 按如图测定空气中氧气的含量时,要达到实验目的,反应物或装置方面应满足的条件是红磷足量(或过量),装置气密性良好等;该实验还可说明氮气具有的性质是氮气不能燃烧,不能支持燃烧、氮气难溶于水等(至少两条).
按如图测定空气中氧气的含量时,要达到实验目的,反应物或装置方面应满足的条件是红磷足量(或过量),装置气密性良好等;该实验还可说明氮气具有的性质是氮气不能燃烧,不能支持燃烧、氮气难溶于水等(至少两条).
分析 在装有空气的密闭容器中,欲用燃烧法测定空气中氧气含量,该实验一般要注意以下几点:①装置的气密性好;②所用药品必须是足量;③读数时一定要冷却到原温度等;根据实验现象及结论推测氮气的性质,据此进行分析解答.
解答 解:按如图测定空气中氧气的含量时,要达到实验目的,反应物红磷要足量(能全部消耗装置内的氧气),装置气密性良好(防止漏气,造成实验结果不准确).
红磷燃烧把氧气耗尽,就不再燃烧,剩余的成分主要是氮气,说明了氮气不能燃烧,也不能支持燃烧;水被倒吸入集气瓶中,剩余的气体中还主要是氮气,说明氮气难溶于水(合理即可).
故答案为:红磷足量(或过量)、装置气密性良好(合理即可);氮气不能燃烧、不能支持燃烧;氮气难溶于水等(合理即可).
点评 本题难度不大,掌握用燃烧法测定空气中氧气含量的实验原理、注意事项等是正确解答本题的关键.

练习册系列答案
相关题目
13.2012年3月22日是第二十届“世界水日”,3月22-28日是第二十五届“中国水周”.下列跟水有关的变化中没有化学变化的是( )
| A. | 海水晒盐 | B. | 太阳能光解水制氢气 | ||
| C. | 饮用水生产 | D. | 肥皂水区分硬水和软水 |
14.著名侯氏制碱法的重要反应之一:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl.在生产中,NaHCO3易结晶析出,经过滤得到NaHCO3晶体和滤液.某化学兴趣小组欲探究所得滤液中溶质的成分,请你参与他们的探究活动.
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ:NH4Cl 猜想Ⅱ:NH4Cl和NaHCO3
猜想Ⅲ:NH4Cl和NaCl 猜想Ⅳ:NH4Cl、NaHCO3和NaCl
【实验分析】
【结论解析】做完步骤③实验后,你得出相关结论的理由是:在滤液中一定含有氯化铵和碳酸氢钠,可能含有氯化钠.
【查阅资料】
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑
【补充实验】另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,往其中滴加稀HNO3酸化后,再滴加AgNO3溶液,若观察到白色沉淀,证明猜想Ⅳ成立,化学方程式AgNO3+NaCl═AgCl↓+NaNO3.
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ:NH4Cl 猜想Ⅱ:NH4Cl和NaHCO3
猜想Ⅲ:NH4Cl和NaCl 猜想Ⅳ:NH4Cl、NaHCO3和NaCl
【实验分析】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液并加热. | 产生刺激性气味气体 | 证明滤液中含有NH4Cl,写出有关化学方程式: NaOH+NH4Cl═NaCl+NH3↑+H2O |
| ②另取少量滤液于试管中,滴加稀盐酸. | 产生无色无味气体 | 证明滤液中含有碳酸氢钠 |
| ③另取少量滤液于试管中,滴加稀HNO3酸化后,再滴加AgNO3溶液. | 产生白色沉淀 | 不能(填“能”或“不能”)证明滤液中含有NaCl. |
【查阅资料】
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑
【补充实验】另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,往其中滴加稀HNO3酸化后,再滴加AgNO3溶液,若观察到白色沉淀,证明猜想Ⅳ成立,化学方程式AgNO3+NaCl═AgCl↓+NaNO3.
18.化学与生活密切相关,下列食物中,主要为人体提供糖类的是( )
| A. |  蔬菜 | B. |  矿泉水 | C. |  米饭 | D. |  花生 |
8.下列说法正确的是( )
| A. | 有单质参加的反应一定是化合反应 | |
| B. | 硝酸铵是一种复合肥料 | |
| C. | 碳酸盐与盐酸反应放出气体,所有与盐酸反应放出气体的物质一定是碳酸盐 | |
| D. | 有盐和水生成的反应不一定是中和反应 |
17.为了测定某黄铜(铜锌合金)中锌的质量分数,某课外兴趣小组利用该合金与实验室中的一瓶稀硫酸反应,进行了若干次实验.现将其中的三次实验数据摘录如下:
请回答下列问题:
(1)第2次实验产生氢气的质量是0.2g.
(2)第2次实验,黄铜与稀硫酸恰好完全反应.
(3)计算黄铜中锌的质量分数(写出计算过程).
| 实验次数 | 1 | 2 | 3 |
| 稀硫酸的质量(g) | 100 | 100 | 100 |
| 加入黄铜的质量(g) | 6.5 | 13 | 19.5 |
| 充分反应后剩余物质的总质量(g) | 106.4 | 112.8 | 119.3 |
(1)第2次实验产生氢气的质量是0.2g.
(2)第2次实验,黄铜与稀硫酸恰好完全反应.
(3)计算黄铜中锌的质量分数(写出计算过程).


