题目内容
20. 右图是A、B、C三种物质的溶解度曲线.
右图是A、B、C三种物质的溶解度曲线.(1)t1℃时,溶解度最大的物质是B(填字母序号).
(2)在t2℃时,把150g A物质的饱和溶液降温到t1℃,析出晶体的质量为25g,此时所得溶液中溶质的质量分数为20%.
(3)若A物质中混有少量的B物质,提纯A物质可采取的方法是降温结晶(填“降温结晶”或“蒸发结晶”).
(4)将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,所得溶液的溶质质量分数的大小关系是:B>A>C.
分析 (1)根据物质的溶解度曲线,t°C时对比三物质的溶解度大小;
(2)根据A在不同温度下的溶解度分析解答,并据饱和溶液中 溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%分析解答;
(3)若A物质中混有少量的B物质,提纯A物质可采取的方法是降温结晶,因为A的溶解度受温度的影响比B大;
(4)据饱和溶液中溶质的质量分数计算方法及物质的溶解度受温度变化情况解答.
解答 解:(1)由A、B、C三种物质的溶解度曲线知,t1℃时,溶解度最大的物质是 B(填字母序号).
(2)在t2℃时A的溶解度是50g,即100g水中最多溶解50g的A,所以150gA物质的饱和溶液中含有50g的A,降温到t1℃时溶解度为25g,所以析出晶体的质量为25g,饱和溶液中 溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,所以此时所得溶液中溶质的质量分数为$\frac{25g}{125g}$×100%=20%;
(3)若A物质中混有少量的B物质,提纯A物质可采取的方法是降温结晶,因为A的溶解度受温度的影响比B大;
(4)a、b的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以将t1℃a、b、c三种物质饱和溶液升温至t2℃时,ab变为不饱和溶液,溶质的质量分数与升温前相等,c的溶解度减小,析出晶体,据饱和溶液质量分数的计算式溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%可知,溶解度越大质量分数也就越大,则三种溶液的溶质质量分数大小关系是B>A>C.
故答案是:(1)B;(2)25;20%;(3)降温结晶;(4)B>A>C.
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

| A. | 38.9% | B. | 56% | C. | 44% | D. | 61% |
| A. | 用含碳酸氢钠的药物治疗胃酸过多症 | |
| B. | 用熟石灰改良酸性土壤 | |
| C. | 蚊虫叮咬人体分泌出蚁酸,涂上氨水可减轻痛痒 | |
| D. | 印染厂的废水中含有少量氢氧化钠,可加入适量稀硫酸除去 |

已知:碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的氢氧化物,这两种氢氧化物均可以和二氧化碳反应.但氢氧化物溶解度有一定的差异,下表所示的是两种氢氧化物在不同温度下的溶解度.
| 温度/℃ | 0 | 40 | 80 |
| Ca(OH)2溶解度/g | 0.187 | 0.141 | 0.094 |
| Ba(OH)2溶解度/g | 1.67 | 8.22 | 101.4 |
(2)除了水之外,进入分离池中的物质是氢氧化钡和氢氧化钙,请你推测分离池中操作②的方法是B(选填“A”或“B”).
A.降温,过滤;B.加热,过滤
(3)写出由溶液B制取产品的化学方程式:Ba(OH)2+CO2=BaCO3↓+H2O;
(4)以下相关说法正确的是ABD.
A.对矿石进行预处理“研磨成粉状”有利于充分反应
B.焙烧炉中添加焦炭粉和热空气是为了维持炉内的高温状态
C.焙烧炉内只涉及分解反应
D.废渣需要经过洗涤才能弃渣,是为了保护环境,同时充分利用原料.
| A. | 盐酸 | B. | 氢氧化钠溶液 | C. | 碳酸钠溶液 | D. | 氢氧化钙溶液 |
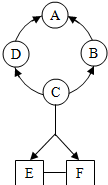 如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.
如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸. 根据图中某牙膏商标上的部分文字,用化学用语填空.
根据图中某牙膏商标上的部分文字,用化学用语填空.