题目内容
18. 某同学做“高锰酸钾制取氧气”的实验过程如下:
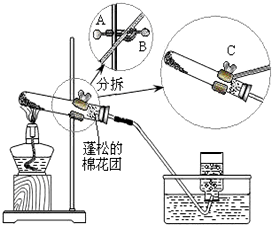
某同学做“高锰酸钾制取氧气”的实验过程如下:①选择适当仪器,组装成如图所示的实验装置;
②检查装置气密性,装置气密性良好;
③向集气瓶中加水,并倒置于盛有水的水槽中,集气瓶底部出现气泡;
④将药品平铺于干燥试管底部,在导管口放置蓬松的棉花团,塞上橡皮塞,固定于铁架台上;
⑤点燃酒精灯加热,待导管口有气泡产生,立即用集气瓶进行收集;
⑥气体收集完毕,用毛玻璃片将集气瓶口盖好,从水中取出并正放在桌面上;
⑦先熄灭酒精灯,后将导管从水槽中取出;…
请回答下列问题:
(1)写出用高锰酸钾制氧气的化学方程式:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)欲调整试管高度,应调节图中A、B、C哪个旋钮:A;
(3)步骤②的操作与观察到的现象是:将导管放入水中,两手紧握住试管,导管口有气泡冒出,松手后导管内形成稳定的水柱;若装置无破损,加热一段时间后,观察到高锰酸钾已大量分解,但导管口仍未产生明显气泡,可能的原因是加入药品后橡皮塞没有塞紧;
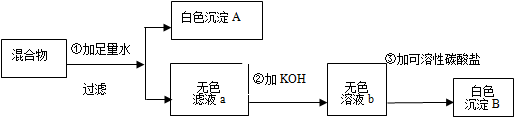
(4)上述实验步骤中,可能导致集气瓶中收集的氧气不纯净(水蒸气不计)的是③⑤;(填序号)
(5)步骤⑦中的操作,可能引起试管炸裂.
分析 (1)根据实验室用高锰酸钾制氧气的反应原理写出反应化学方程式;
(2)根据铁架台上三个旋钮的不同作用进行调整试管的高度;
(3)根据实验室检查装置的气密性的方法,漏气的原因进行解答;
(4)根据实验室制取氧气的装置,操作步骤 连→查→装→定→点→收→移→熄,及注意事项进行解答;
(5)根据实验室制取氧气的注意事项进行解答.
解答 解:(1)根据实验室用高锰酸钾制氧气的反应原理可知反应化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)根据铁架台上三个旋钮的不同作用,依据图示可知A可以调节试管的整个高度,B处调整试管的倾斜度,C处调整夹持试管的牢固程度,故选A;
(3)根据检查装置气密性的方法:将导管插入水中,手握住试管,如果导管口有气泡冒出,松开手后,导管内有一段上升液柱,说明该装置气密性良好,证明不漏气;装置无破损,加热到高锰酸钾已大量分解,导管口仍未产生明显气泡,则可能是加入药品后橡皮塞没有塞紧;
(4)实验过程中,在向集气瓶内加水时,由于水未加满致使瓶底出现气泡,结果造成收集的氧气纯度不够;
待导管口有气泡产生,立即用集气瓶进行收集,也能造成氧气纯度不够;
(5)由于没有移出水槽中的导管就熄灭了酒精灯,导致试管内压强骤然减小,水槽中的水沿导管进入试管,水倒流入热的试管,试管突然遇冷从而炸裂;
故答案为:(1)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)A;
(3)将导管放入水中,两手紧握住试管,导管口有气泡冒出,松手后导管内形成稳定的水柱; 加入药品后橡皮塞没有塞紧;
(4)③⑤;
(5)试管炸裂.
点评 本题考查学生根据实验室氧气的制取的装置,步骤,注意事项进行分析解题的能力,掌握相关知识即可顺利解答.

他做了一组实验:每次均取5ml30%的双氧水溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他条件相同)
请根据表中的数据回答:
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 双氧水溶液的 溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2 粉末的 质量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集500 ml气体 所用的时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后溶液的温度(℃) | 24 | 34 | 39 | 65 | 70 | 79 | 85 | 90 |
(2)还有哪些因素可能影响该反应速率呢?请你说出一个猜想:其他条件不变时,改变此反应的温度,可加快此反应的速率(可从温度、催化剂等方面进行猜想).
(3)同学在室温中要收集5L,需要多少克30%的双氧水溶液(20℃室温中氧气的密度为1.4克/升,计算最后结果精确到0.01,)49.58g.
| A. | 可能是2克氢气和8克氧气 | B. | 一定是1克氢气和9克氧气 | ||
| C. | 可能是5克氢气和5克氧气 | D. | 一定是4克氢气和6克氧气 |
| A. | 细铁丝在氧气中燃烧 | B. | 铁与硫酸反应 | ||
| C. | 氢气在氧气中燃烧 | D. | 铁与硫酸铜反应 |
 雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:
雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题: