题目内容
6.将下列物质分类:①液氧 ②澄清石灰水 ③水银 ④洁净的空气 ⑤冰水混合物 ⑥二氧化碳 ⑦五氧化二磷 ⑧高锰酸钾制氧气后的剩余固体 ⑨氯酸钾 ⑩氮气
(1)属于混合物的是②④⑧ (填序号,下同);
(2)属于纯净物的是①③⑤⑥⑦⑨⑩.
分析 物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成,纯净物是由一种物质组成,据此分析物质的类别.
解答 解:混合物是由两种或两种以上的物质组成,洁净的空气、高锰酸钾制取氧气后的剩余固体是锰酸钾和二氧化锰,它们都属于混合物;纯净物是由一种物质组成,冰水混合物中只有水分子、液氧、水银、五氧化二磷、氯酸钾、氮气都是由一种物质组成,它们都属于纯净物,
故答案为:②④⑧;①③⑤⑥⑦⑨⑩;
点评 本考点考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.

练习册系列答案
相关题目
16.工业上利用太阳能进行海水晒盐.已知海水蒸发浓缩过程中析出盐的种类和质量如下表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
(1)海水从密度为1.21g•mL-1浓缩到1.22g•mL-1时发生的变化是C.
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是硫酸钙.实际晒盐生产中,海水的密度一般控制在1.21g•mL-1~1.26g•mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-;Br-.
(3)如图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是B.

| 海水密度/(g•mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是硫酸钙.实际晒盐生产中,海水的密度一般控制在1.21g•mL-1~1.26g•mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-;Br-.
(3)如图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是B.

17.把金属X放入CuSO4溶液中,X表面有红色固体析出;若放入FeSO4溶液中,无明显现象. 则X、Cu、Fe三种金属活动性由强到弱的顺序正确的是( )
| A. | Fe、X、Cu | B. | X、Fe、Cu | C. | Fe、Cu、X | D. | Cu、X、Fe |
14.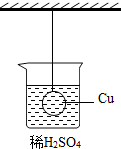 如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
 如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
11.一个碳原子的质量为b千克,其相对原子质量为12;一个氧原子的质量为a千克,则该氧原子的相对原子质量为( )
| A. | 16 | B. | $\frac{b}{12a}$ | C. | $\frac{a}{12b}$ | D. | $\frac{12a}{b}$ |
16.下列各说法正确的是( )
| A. | 在铁板表面镀上一层锌称为白铁,白铁是铁锌合金 | |
| B. | 铁是地壳中含量最多的金属元素 | |
| C. | 高炉炼出来的是生铁,不是钢 | |
| D. | 从高炉排出的废气,可以直接放空 |
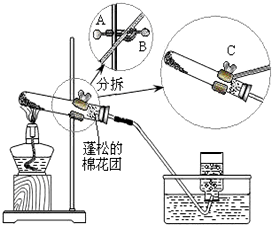 某同学做“高锰酸钾制取氧气”的实验过程如下:
某同学做“高锰酸钾制取氧气”的实验过程如下:


