题目内容
1.实验室常用锌和稀硫酸反应制取氢气,反应的化学方程式是:Zn+H2SO4=ZnSO4+H2↑.如果用6.5g锌与足量的稀硫酸反应,可制取氢气的质量是多少?这些氢气的体积是多少?(氢气的密度是0.09g/L)分析 欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出生成氢气的质量.
解答 解:设生成氢气的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
6.5g x
$\frac{65}{2}=\frac{6.5g}{x}$
x=0.2g
氢气的体积是:$\frac{0.2g}{0.09g/L}$≈2.2L
答:生成氢气的质量为0.2g,氢气的体积是2.2L.
点评 本题主要考查学生运用化学方程式进行计算的能力.

练习册系列答案
相关题目
12.下列说法中,有错误的是( )
| A. | 一氧化碳与二氧化碳的分子构成不同,使得它们的化学性质有很大差别 | |
| B. | 将燃着的硫磺伸入盛有氧气的集气瓶中,产生明亮的蓝紫色火焰 | |
| C. | 所有的盐类物质和食盐一样,均能作为调味品 | |
| D. | 中和反应产物中一定有水,但产物中有水的反应不一定是中和反应 |
11.请仔细研读下列表格中的例子.
表中有许多规律,如“单质中只含有一种元素”,“化合物中含有两种或两种以上的元素”,相信你在物质分类方面还会发现其它的规律:
(1)化合物中含有不同的元素;
(2)氧化物中含有两种元素,其中一种是氧元素;
(3)单质分为金属单质和非金属单质.
| 物质分类 | 物质举例 |
| 单质 | 氧气(O2)、氮气(N2)、碳(C)、硫(S)、铜(Cu)、汞(Hg) |
| 化合物 | 二氧化碳(CO2)、硝酸(HNO3)、熟石灰([Ca(OH)2])、碳酸钙(CaCO3)、氯化钠(NaCl)、烧碱(NaOH)、氧化镁(MgO)、盐酸(HCl) |
(1)化合物中含有不同的元素;
(2)氧化物中含有两种元素,其中一种是氧元素;
(3)单质分为金属单质和非金属单质.

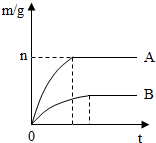 取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.
取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.


 ③C=O=C ④
③C=O=C ④
