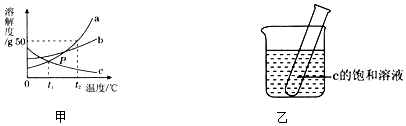
题目内容
9.在稀硫酸中存在的自由移动的微粒是H+、SO42-、H2O,它能和氢氧化钠溶液发生中和反应,反应过程中不断减少的微粒是H+和OH-.分析 根据稀硫酸中含有氢离子和硫酸根离子,结合中和反应的实质是氢离子与氢氧根离子结合生成水分子,进行分析解答.
解答 解:稀硫酸是硫酸的水溶液,硫酸中含有氢离子和硫酸根离子,在稀硫酸中存在的自由移动的微粒是H+、SO42-、H2O.
它能和氢氧化钠溶液发生中和反应,硫酸与氢氧化钠反应生成硫酸钠和水,反应的实质是氢离子与氢氧根离子结合生成水分子,反应过程中不断减少的微粒是氢离子和氢氧根离子.
故答案为:H+、SO42-、H2O;H+和OH-.
点评 本题难度不大,掌握中和反应的实质(氢离子与氢氧根离子结合生成水分子)、常见物质的微观构成是正确解答本题的关键.

练习册系列答案
相关题目
10.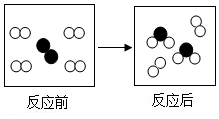 如图是某个化学反应的微观示意图,图中“〇”、“●”表示不同元素的原子.从图中获得的有关信息不正确的是( )
如图是某个化学反应的微观示意图,图中“〇”、“●”表示不同元素的原子.从图中获得的有关信息不正确的是( )
 如图是某个化学反应的微观示意图,图中“〇”、“●”表示不同元素的原子.从图中获得的有关信息不正确的是( )
如图是某个化学反应的微观示意图,图中“〇”、“●”表示不同元素的原子.从图中获得的有关信息不正确的是( )| A. | 化学反应中分子可分为原子 | B. | 该反应为置换反应 | ||
| C. | 反应前后原子的种类不变 | D. | 生成物为化合物 |
1.下列属于物理变化的是( )
| A. | 蛋白质盐析 | B. | 百炼成钢 | C. | 大米酿酒 | D. | 煤的干馏 |
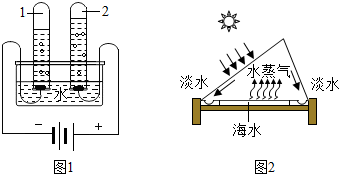
 合理利用化学知识,生活更科学、更美好.
合理利用化学知识,生活更科学、更美好.