题目内容
12.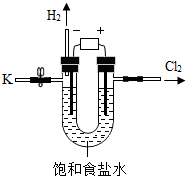 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.提示:I.电解饱和食盐水的反应,见本试卷30题.
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)检验含有氢氧化钠的方法是取样,滴加几滴无色酚酞试液,溶液变红色.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐加
入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据
如下:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应从选用稀盐酸的体积为9.8mL.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按如图所示的实验步骤进行实验:
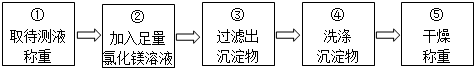
(4)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,往上层澄清液体中继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
分析 (1)氢氧化钠溶液显碱性,能使酚酞试液变红色;
(2)氢氧化钠与稀盐酸反应生成氯化钠和水;
(3)稀盐酸和氢氧化钠恰好完全反应时,溶液显中性,pH=7;
(4)氢氧化钠和氯化镁反应生成白色沉淀氢氧化镁和氯化钠;
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,则氢氧化镁沉淀上会附着部分杂质.
解答 解:(1)检验含有氢氧化钠的方法是取样,滴加几滴无色酚酞试液,溶液变红色.
故填:取样,滴加几滴无色酚酞试液,溶液变红色.
(2)氢氧化钠与稀盐酸反应的化学方程式为:NaOH+HCl═NaCl+H2O.
故填:NaOH+HCl═NaCl+H2O.
(3)稀盐酸和氢氧化钠恰好完全反应时,溶液显中性,pH=7,当恰好完全反应时消耗稀盐酸的体积为9.8mL.
故填:9.8.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应;
滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,往上层澄清液体中继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量.
故填:使NaOH完全反应;往上层澄清液体中继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量.
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,则氢氧化镁沉淀上会附着部分杂质,导致所测定氢氧化钠的质量分数将偏大.
故填:偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.将一块生铁投入盛有足量稀盐酸的烧杯中,充分反应后,下列叙述不正确的是( )
| A. | 该反应属于置换反应 | B. | 在生铁表面有气泡产生 | ||
| C. | 溶液中有黑色固体残留 | D. | 溶液颜色由无色变为黄色 |
20.依据如图是某芝麻酱说明书,下列关于该芝麻酱判断正确的是( )

| A. | 不含微量元素 | B. | 不含糖类和油脂 | ||
| C. | 婴儿要慎用 | D. | 钙含量高于蛋白质 |
17.实验室配制50g质量分数为4%的氢氧化钠溶液,下列描述正确的是( )
| A. | 计算需氢氧化钠2g、水50g | |
| B. | 将氢氧化钠固体放于纸上称量 | |
| C. | 把氢氧化钠固体放入量筒中溶解 | |
| D. | 将配好的氢氧化钠溶液装瓶并密封保存 |
4.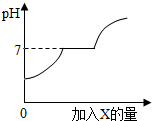 现有盐酸和CaCl2的混合溶液(CaCl2水溶液呈中性),向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
现有盐酸和CaCl2的混合溶液(CaCl2水溶液呈中性),向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
 现有盐酸和CaCl2的混合溶液(CaCl2水溶液呈中性),向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
现有盐酸和CaCl2的混合溶液(CaCl2水溶液呈中性),向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )| A. | 水 | B. | 纯碱溶液 | C. | 石灰石 | D. | 石灰水 |
1.有关CuSO4制备途径及性质如图所示.
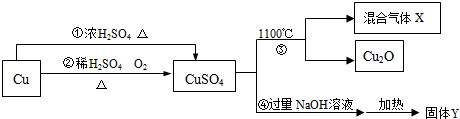
已知:
(1)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O.
(2)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.下列说法不正确的是( )

已知:
(1)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O.
(2)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.下列说法不正确的是( )
| A. | 途径②比途径①更好地体现绿色化学思想 | |
| B. | 生成等质量的硫酸铜,途径①中消耗硫酸的质量多 | |
| C. | 反应③分解所得混合气体X的成分是SO2和SO3 | |
| D. | 固体Y为CuO |
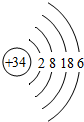 ,硒单质是红色或灰色粉末,带灰色金属光泽,导电性随光照强度急剧变化,可制半导体和光敏材料.硒在空气中燃烧发出蓝色火焰,生成二氧化硒.工业是可以利用反应Na2SeSO3→Na2SO3+Se来制备硒单质.
,硒单质是红色或灰色粉末,带灰色金属光泽,导电性随光照强度急剧变化,可制半导体和光敏材料.硒在空气中燃烧发出蓝色火焰,生成二氧化硒.工业是可以利用反应Na2SeSO3→Na2SO3+Se来制备硒单质.