题目内容
13.学习了酸、碱、盐有关知识后,小明在实验室称量氢氧化钠固体,配制了溶质质量分数为10%的氢氧化钠溶液,进行以下探究:
(1)若图Ⅰ中游码标尺读数为1.8,则他称取的氢氧化钠质量是5.2g.
(2)图Ⅱ中反应的化学方程式是HCl+NaOH=NaCl+H2O.
(3)图Ⅲ中玻璃棒的作用是搅拌,防止局部温度过高而使液体飞溅,当出现较多固体时,应停止加热.
分析 (1)物码倒置时,称量物的质量=砝码-游码;
(2)根据反应原理书写方程式;
③根据蒸发操作中玻璃棒的作用及注意事项作答.
解答 解:(1)据图可知,该同学称量时氢氧化钠和砝码的位置放反了,砝码的读数是7g,游码的读数是1.8g,故氢氧化钠的质量=7g-1.8g=5.2g;
(2)稀盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O;
(3)蒸发操作时,玻璃棒的作用是搅拌,防止局部温度过高而使液体飞溅,待有较多固体出现即可停止加热,剩余的液体利用蒸发皿的余温可以蒸发干;
故答案为:(1)5.2;
(2)HCl+NaOH=NaCl+H2O;
(3)搅拌,防止局部温度过高而使液体飞溅;停止加热.
点评 本题主要考查了玻璃棒、托盘天平等常见仪器的用途,方程式的书写等知识,掌握相关知识即可顺利解答.

练习册系列答案
相关题目
13. 如图是A、B、C三种物质的溶解度曲线,说法错误的是( )
如图是A、B、C三种物质的溶解度曲线,说法错误的是( )
 如图是A、B、C三种物质的溶解度曲线,说法错误的是( )
如图是A、B、C三种物质的溶解度曲线,说法错误的是( )| A. | 物质A的溶解度随温度的升高而增大 | |
| B. | t1℃时,物质C饱和溶液的溶质质量分数为20% | |
| C. | 将t2℃时物质C的饱和溶液降温到t1℃时,溶液浓度变大 | |
| D. | 将t2℃时的物质A、B饱和溶液降温到t1℃时,两溶液的浓度B>A |
1.测定硫酸铜晶体(CuSO4•XH2O)结晶含量的实验流程如下:
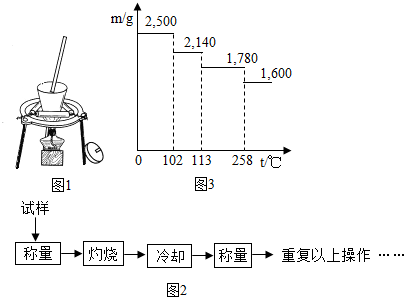
回答下列问题:
(1)“冷却”必须在干燥中进行,其原因是硫酸铜能和水反应;
(2)小夏实验后得到以下数据(相对原子质量H:1O:16S:32Cu:64):
根据以上数据计算该硫酸铜晶体样品中结晶水的x的值为4,做此实验时,最少应称量4次.
(3)从下列分析中选出该学生产生实验误差的原因可能是abd.
a、硫酸铜晶体样品中含有不可能分解的杂质
b、硫酸铜晶体样品未加热完全就开始冷却
c、加热过程中晶体有少量溅出
d、加热完毕后,露置在空气中冷却
e、加热前晶体潮湿带水
(4)另一小组称取2.500g纯的胆矾晶体逐渐升温使其失水,并准确测定不同温度下剩余固体的质量(m)得到如图3所示的实验结果,则加热温度在110℃时硫酸铜结晶水合物的化学式为CuSO4•3H2O.

回答下列问题:
(1)“冷却”必须在干燥中进行,其原因是硫酸铜能和水反应;
(2)小夏实验后得到以下数据(相对原子质量H:1O:16S:32Cu:64):
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m(容器+无水硫酸铜) |
| 5.400g | 7.900g | 7.100g |
(3)从下列分析中选出该学生产生实验误差的原因可能是abd.
a、硫酸铜晶体样品中含有不可能分解的杂质
b、硫酸铜晶体样品未加热完全就开始冷却
c、加热过程中晶体有少量溅出
d、加热完毕后,露置在空气中冷却
e、加热前晶体潮湿带水
(4)另一小组称取2.500g纯的胆矾晶体逐渐升温使其失水,并准确测定不同温度下剩余固体的质量(m)得到如图3所示的实验结果,则加热温度在110℃时硫酸铜结晶水合物的化学式为CuSO4•3H2O.
2. 如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )
如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )
 如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )
如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )| A. | 该反应可能为N2+2S2M=2M+2S2N | B. | 可能是氢气与氧化铜的反应 | ||
| C. | 该反应属于分解反应 | D. | R在该反应中一定发挥着催化作用 |
3.下列反应的化学方程式正确的是( )
| A. | 铜加到硝酸银溶液中:Cu+AgNO3═CuNO3+Ag | |
| B. | 电解水:2H2O═2H2↑+O2↑ | |
| C. | 硫酸镁溶液与氢氧化钠溶液混合:MgSO4+2NaOH═Mg(OH)2↓+Na2SO4 | |
| D. | 甲醇燃烧:CH3OH+O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+H2O |
 (1)规范的实验操作是实验成功的前提.请回答:
(1)规范的实验操作是实验成功的前提.请回答: