题目内容
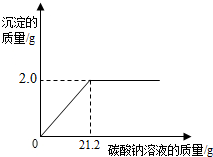 现有一包只含有氯化钙杂质的粗盐样品.某校化学小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100mL水中(水的密度是1g/cm3),再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如下图所示.试计算:
现有一包只含有氯化钙杂质的粗盐样品.某校化学小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100mL水中(水的密度是1g/cm3),再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如下图所示.试计算:(1)该粗盐样品中氯化钙的质量分数.
(2)所加Na2CO3溶液的质量.
(3)过滤后所得滤液中溶质的质量分数.(精确到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)欲求该粗盐样品中氯化钙的质量分数,须先根据化学方程式中沉淀质量求出样品中氯化钙的质量,再利用质量分数公式计算即可.
(2)根据化学方程式中沉淀质量求出碳酸钠质量,再利用质量分数公式计算即可.
(3)欲求所的滤液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=
×100%计算即可;此题需根据质量守恒定律求得滤液质量.
(2)根据化学方程式中沉淀质量求出碳酸钠质量,再利用质量分数公式计算即可.
(3)欲求所的滤液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:水的质量:100mL×1g/cm3=100g;
设粗盐样品中氯化钙的质量为x,消耗的碳酸钠的质量为y,生成的NaCl质量为z,则
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100 117
y x 2.0g z
=
,x=2.22g;
=
,y=2.12g;
=
,z=2.34g;
(1)粗盐样品中氯化钙的质量分数:
×100%=22.2%;
(2)所加Na2CO3溶液的质量:
=21.2g;
(3)滤液中溶质的质量分数:
×100%=7.8%,
答:(1)粗盐样品中氯化钙的质量分数22.2%,
(2)所加Na2CO3溶液的质量21.2g,
(3)滤液中溶质的质量分数7.8%.
设粗盐样品中氯化钙的质量为x,消耗的碳酸钠的质量为y,生成的NaCl质量为z,则
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100 117
y x 2.0g z
| 111 |
| x |
| 100 |
| 2.0g |
| 106 |
| y |
| 100 |
| 2.0g |
| 100 |
| 2.0g |
| 117 |
| z |
(1)粗盐样品中氯化钙的质量分数:
| 2.22g |
| 10g |
(2)所加Na2CO3溶液的质量:
| 2.12g |
| 10% |
(3)滤液中溶质的质量分数:
| 2.34g+10g-2.22g |
| 10g+100g+21.2g-2.0g |
答:(1)粗盐样品中氯化钙的质量分数22.2%,
(2)所加Na2CO3溶液的质量21.2g,
(3)滤液中溶质的质量分数7.8%.
点评:本题主要考查学生对物质质量分数和溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.

练习册系列答案
相关题目
一壶水烧开了,壶盖被顶开,这是因为( )
| A、水分子变大了 |
| B、水分子变多了 |
| C、水分子不停地运动 |
| D、水分子之间的间隔变大了 |

