题目内容
(1)铝合金应用广泛,抗腐蚀性强,是因为 ;
(2)将铁粉加入CuSO4溶液中,充分反应后过滤,向所得物体加入稀盐酸,产生气泡,则滤纸上的物质是 ,溶液中的溶质是 .
(2)将铁粉加入CuSO4溶液中,充分反应后过滤,向所得物体加入稀盐酸,产生气泡,则滤纸上的物质是
考点:金属的化学性质
专题:金属与金属材料
分析:(1)铝与空气中的氧气反应,生成致密的氧化铝,具有保护作用;
(2)根据金属与酸反应的规律,判断过滤出固体金属的成分,由此进一步分析金属与盐溶液的反应,完成对反应后所得溶液组成的判断.
(2)根据金属与酸反应的规律,判断过滤出固体金属的成分,由此进一步分析金属与盐溶液的反应,完成对反应后所得溶液组成的判断.
解答:解:
(1)铝与空气中的氧气反应,生成致密的氧化铝薄膜,具有保护作用,故反应的化学方程式是:
4Al+3O2═2Al2O3;
(2)铁的活动性比铜强,铁粉放入硫酸铜溶液反应生成铜和硫酸亚铁;其化学方程式为:Fe+CuSO4═FeSO4+Cu;充分反应后过滤,向所得物体加入稀盐酸,产生气泡,说明固体中含铁粉,则可知加入硫酸铜溶液中的铁粉过量,反应后的溶液中一定含有硫酸亚铁;
故答案为:
(1)铝与空气中的氧气反应,生成致密的氧化铝薄膜,具有保护作用;
(2)Fe、Cu;硫酸亚铁.
(1)铝与空气中的氧气反应,生成致密的氧化铝薄膜,具有保护作用,故反应的化学方程式是:
4Al+3O2═2Al2O3;
(2)铁的活动性比铜强,铁粉放入硫酸铜溶液反应生成铜和硫酸亚铁;其化学方程式为:Fe+CuSO4═FeSO4+Cu;充分反应后过滤,向所得物体加入稀盐酸,产生气泡,说明固体中含铁粉,则可知加入硫酸铜溶液中的铁粉过量,反应后的溶液中一定含有硫酸亚铁;
故答案为:
(1)铝与空气中的氧气反应,生成致密的氧化铝薄膜,具有保护作用;
(2)Fe、Cu;硫酸亚铁.
点评:溶液中的硫酸铜是否完全反应是本题分析的关键,而题中关键确定铁粉的量,是否完全反应,因此需要对反应后溶液的成分进行讨论.

练习册系列答案
相关题目
你认为下列选项不属于化学这门自然科学研究范畴的是( )
| A、物质的运动形式 |
| B、物质的变化规律和性质 |
| C、物质的组成和结构 |
| D、物质的用途和制取 |
浙江一运输四氯乙烷(C2H2Cl4)危险品车侧翻致泄漏至富春江,四氯乙烷(又名四氯化乙炔)是一种化学品,本品不燃,有毒,具刺激性气味.微溶于水,溶于乙醇、乙醚等.下列有关说法正确的是( )
| A、四氯乙烷中含有8个原子 |
| B、因微溶于水,不会对富春江造成水体污染 |
| C、四氯乙烷是有机高分子化合物 |
| D、四氯乙烷中碳、氢、氯元素原子个数比为1:1:2 |

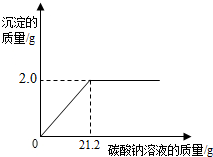 现有一包只含有氯化钙杂质的粗盐样品.某校化学小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100mL水中(水的密度是1g/cm3),再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如下图所示.试计算:
现有一包只含有氯化钙杂质的粗盐样品.某校化学小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100mL水中(水的密度是1g/cm3),再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如下图所示.试计算:

 如图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物.胃液中含有适量的甲,可帮助消化,图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物,生成物略去.
如图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物.胃液中含有适量的甲,可帮助消化,图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物,生成物略去. 水和溶液在生活中起着十分重要的作用.
水和溶液在生活中起着十分重要的作用.