题目内容
2.在3Cu+8HNO3(稀)═3Cu(NO3)2+2X↑+4H2O反应中:(1)X的化学式为NO;
(2)HNO3中N元素的化合价为+5;
(3)Cu(NO3)2中铜元素、氧元素的质量比为2:3;
(4)上述各物质中,直接由原子构成的是铜;水分子由氢原子、氧原子构成.
分析 (1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
(2)根据在化合物中正负化合价代数和为零,结合硝酸的化学式进行解答本题.
(3)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(4)根据物质的构成分析即可
解答 解:(1)根据反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2X↑+4H2O,反应物中铜、氢、氮、氧原子个数分别为3、8、8、24,反应后的生成物中铜、氢、氮、氧原子个数分别为3、8、6、22,根据反应前后原子种类、数目不变,则2X中含有2个氮原子和2个氧原子,则每个X分子由1个氮原子和1个氧原子构成,则物质X的化学式为NO.
(2)氢元素显+1价,氧元素显-2价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价.
(3)Cu(NO3)2中铜元素、氧元素的质量比为64:(16×3×2)=2:3.
(4)该反应涉及的物质中,直接由原子构成的是铜;水分子由氢原子、氧原子构成.
故答案为:(1)NO;(2)+5;(3)2:3;(4)铜;氢原子、氧原子
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.类推是科学学习中常用的思维方法.现有以下类推结果,其中正确的是( )
| A. | 酸能与碱发生中和反应生成盐和水,则能与酸反应生成盐和水的物质一定是碱 | |
| B. | 氧化物中都含有氧元素,则含有氧元素的化合物一定是氧化物 | |
| C. | 碱溶液PH>7,则PH>7的溶液一定是碱溶液 | |
| D. | 点燃H2和O2的混合气体可能发生爆炸,则点燃CH4与O2的混合气体也可能爆炸 |
7.为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,同学们通过测定了反应后溶液的pH,得到了如图1所示的pH曲线,请回答:
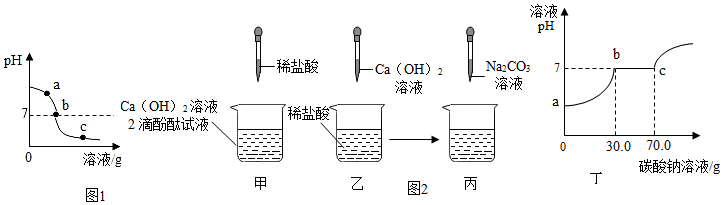
(1)由图可知该实验操作是将稀盐酸 滴加到另一种溶液中
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色
的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
(4)同学们做甲、乙两个中和反应实验的探究(如图2).
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图丁所示.请计算该溶液中CaCl2的溶质质量分数.(写出计算过程,精确到0.1%)

(1)由图可知该实验操作是将稀盐酸 滴加到另一种溶液中
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色
的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 另取少量余下样品于两支试管中,分别滴加足量的Na CO,溶液 | 只产生白色沉淀 | 该样品为b处溶液 |
| 先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知液中的阳离子有Ca2+、H+ |
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图丁所示.请计算该溶液中CaCl2的溶质质量分数.(写出计算过程,精确到0.1%)