题目内容
9.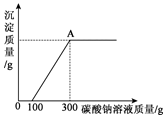 为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液224.4克于烧杯中,在不断振荡的条件下,向其中逐滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示.经测定A中只含有一种溶质.根据题中有关信息和图象分析回答下列问题.
为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液224.4克于烧杯中,在不断振荡的条件下,向其中逐滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示.经测定A中只含有一种溶质.根据题中有关信息和图象分析回答下列问题.(1)原废液中的溶质成分有CaCl2,HCl(用化学式回答)
(2)该碳酸钠溶液中钠元素的质量分数为4.6%(结果保留到0.1%)
(3)A点处溶液中溶质的质量分数是多少?(列出必要的解题步骤,结果保留到0.1%)
分析 (1)根据石灰石与盐酸反应后的废液中一定含有溶质氯化钙,加入碳酸钠开始没有沉淀生成,说明废液中含有多余的盐酸进行分析;
(2)根据碳酸钠溶液的质量和溶质质量分数计算碳酸钠的质量,然后计算钠元素的质量分数;
(3)根据A点处溶液中溶质氯化钠中的钠元素完全来自于碳酸钠中的钠元素,碳酸钠溶液的质量和溶质质量分数可以计算钠元素的质量,进一步可以计算氯化钠的质量,从而可以计算A点处溶液中溶质的质量分数.
解答 解:(1)石灰石与盐酸反应后的废液中一定含有溶质氯化钙,加入碳酸钠开始没有沉淀生成,说明废液中含有多余的盐酸,所以含有的溶质有CaCl2,HCl;
(2)碳酸钠溶液中钠元素的质量分数为:$\frac{300g×10.6%×\frac{46}{106}}{300g}$=4.6%;
(3)设A点处溶液中溶质氯化钠的质量为y,
由Na2CO3+2HCl═2NaCl+H2O+CO2↑,Na2CO3+CaCl2═CaCO3↓+2NaCl 可知,
Na2CO3~2NaCl,
106 117
300g×10.6% y
$\frac{106}{300g×10.6%}$=$\frac{117}{y}$
y=35.1g
设生成沉淀的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
200g×10.6% x
$\frac{106}{200g×10.6%}$=$\frac{100}{x}$
x=20g
设碳酸钠和稀盐酸反应生成二氧化碳的质量为z,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 44
100g×10.6% z
$\frac{106}{100g×10.6%}$=$\frac{44}{z}$
z=4.4g
A点处溶液中溶质的质量分数为:$\frac{35.1g}{224.4g+300g-20g-4.4g}$×100%=7.0%.
答:A点处溶液中溶质的质量分数为6.1%.
故答案为:(1)CaCl2,HCl;
(2)4.6%;
(3)7.0%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了分析数据的能力,计算时要注意规范性和准确性.

 智慧小复习系列答案
智慧小复习系列答案| A. | 血液,pH为7.35~7.45 | B. | 胃液,pH为0.8~1.5 | ||
| C. | 牛奶,pH为6.3~6.6 | D. | 苹果汁,pH为2.9~3.3 |
| A. | NaOH (Na2CO3):盐酸 | B. | CO2 (O2):灼热的铜粉 | ||
| C. | CO (CO2):氢氧化钠溶液 | D. | O2 (H2O):浓硫酸 |
| A. | 用10mL量筒量取10mL水 | |
| B. | 为了加快过滤速度,用玻璃棒搅动过滤器里的液体 | |
| C. | 稀释浓硫酸时,应将浓硫酸慢慢加入水中,并用玻璃棒不断搅拌 | |
| D. | 实验室用排水法收集气体时,一有气泡冒出马上收集,以免造成浪费 | |
| E. | 切忌向燃着的酒精灯内添加酒精,可以用燃着的酒精灯去点燃另一盏酒精灯 | |
| F. | 取用液体药品时,要把瓶塞倒放在桌面上,标签朝向手心,放回原处时标签向外 | |
| G. | 为了测定溶液的酸碱度,可以选择紫色石蕊试液进行检验 |


 为测定某铁粉样品(含少量木炭粉)中铁的含量,往盛有219g稀盐酸的烧杯中不断加入铁粉样品,测得生成氢气的质量与所加铁粉样品的质量关系如图所示.
为测定某铁粉样品(含少量木炭粉)中铁的含量,往盛有219g稀盐酸的烧杯中不断加入铁粉样品,测得生成氢气的质量与所加铁粉样品的质量关系如图所示.