题目内容
4.“低碳”是全世界的主题.以下流程是通过控制化学反应的条件来促进或抑制化学反应,实现“低碳”,从而更好地通过化学反应为人类造福.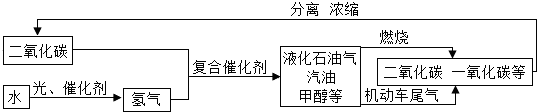
根据上述流程回答下列问题:
(1)上述流程可循环利用的物质是二氧化碳.
(2)从图中分析得出的下列结论中,不正确的是AC(填字母).
A.水生成氢气的过程中所用的催化剂一定是二氧化锰
B.二氧化碳与氢气在复合催化剂的作用下的反应产物是混合物
C.分离、浓缩得到二氧化碳的过程是化学变化
(3)甲醇(CH3OH)燃烧除了生成二氧化碳外,还生成一种常温下为液态的化合物,写出反应的化学方程式2CH3OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O,如何证明燃烧产物中含有二氧化碳,你设计的实验方法是实验步骤:点燃甲醇,在火焰上方放置一个涂有澄清石灰水的玻璃片;
实验现象:澄清石灰水变浑浊;
实验结论:甲醇燃烧生成了二氧化碳.
分析 (1)由图中变成过程可知,二氧化碳可以循环利用;
(2)分解水的催化剂不一定是二氧化锰;
根据生成物的种类可以判断相关方面的问题;
生成新物质的变化属于化学变化;
(3)甲醇燃烧生成水和二氧化碳.
解答 解:(1)上述流程可循环利用的物质是二氧化碳.
故填:二氧化碳.
(2)A.水生成氢气的过程中所用的催化剂不一定是二氧化锰,该选项说法不正确;
B.二氧化碳与氢气在复合催化剂的作用下的反应产物是液化石油气、汽油、甲醇等物质,属于混合物,该选项说法正确;
C.分离、浓缩得到二氧化碳过程中没有生成新物质,属于物理变化,该选项说法不正确.
故填:AC.
(3)甲醇燃烧生成水和二氧化碳,反应的化学方程式为:2CH3OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O;
证明燃烧产物中含有二氧化碳的实验方法是:实验步骤:点燃甲醇,在火焰上方放置一个涂有澄清石灰水的玻璃片;
实验现象:澄清石灰水变浑浊;
实验结论:甲醇燃烧生成了二氧化碳.
故填:2CH3OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O;实验步骤:点燃甲醇,在火焰上方放置一个涂有澄清石灰水的玻璃片;
实验现象:澄清石灰水变浑浊;
实验结论:甲醇燃烧生成了二氧化碳.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
7.只用一种试剂就可一次性鉴别稀硫酸,烧碱溶液、食盐溶液的是( )
| A. | 纯碱溶液 | B. | 酚酞试液 | C. | 石蕊试液 | D. | 稀盐酸 |
16.医用CaCl2•2H2O可用于补钙、抗过敏和消炎等,以某碳酸钙样品(其中含少量Al3+、Fe3+等杂质)生产医用CaCl2•2H2O的工艺流程为:
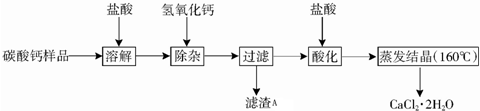
已知:查阅资料得知氢氧化物沉淀及溶解时的pH为:
(1)在实验室进行溶解时玻璃棒的作用是搅拌,加速溶解,过滤时用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)除杂操作是加入稍过量的氢氧化钙,调节溶液的pH使Al3+、Fe3+全部转化为沉淀,此时应该控制溶液的pH值X的范围是4.0~7.8;滤渣A的主要成分的化学式为Fe(OH)3、Al(OH)3.
(3)酸化时加盐酸的主要目的为了将氢氧化钙转化为氯化钙.
(4)若所用碳酸钙样品12.5Kg,最后所得的产物中含氯化钙11.1Kg,则样品中碳酸钙的质量分数最大为多少?(写出计算过程)

已知:查阅资料得知氢氧化物沉淀及溶解时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.0 | 7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 10.8 |
(2)除杂操作是加入稍过量的氢氧化钙,调节溶液的pH使Al3+、Fe3+全部转化为沉淀,此时应该控制溶液的pH值X的范围是4.0~7.8;滤渣A的主要成分的化学式为Fe(OH)3、Al(OH)3.
(3)酸化时加盐酸的主要目的为了将氢氧化钙转化为氯化钙.
(4)若所用碳酸钙样品12.5Kg,最后所得的产物中含氯化钙11.1Kg,则样品中碳酸钙的质量分数最大为多少?(写出计算过程)
14.下列实验中不可能成功的是( )
| A. | 将一只冷碟子放在蜡烛火焰上方获得炭黑 | |
| B. | 用过滤法使硬水转化成软水 | |
| C. | 用食醋区分食盐和纯碱 | |
| D. | 用牵牛花和酒精自制酸碱指示剂 |